
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лужність води
|
|
(визначення карбонатного та гідрокарбонатного іонів)
Загальна лужність природних вод утворюється аніонами слабких кислот: HCO3-, CO32-, SiO32-, HS-, а в болотяних та нафтових водах - аніонами органічних кислот. Вміст усіх перелічених аніонів, за винятком карбонатних та гідрокарбонатних, у природних водах дуже малий, тому за значення загальної лужності води приймають вміст карбонатних та гідрокарбонатних іонів.
Визначення карбонатного та гідрокарбонатного іонів проводять методом тітрування проби води соляною кислотою. Реакція йде у дві фази:
1) СO32- + H+ ↔ HCO3- ; 2) HCO3- + H+ → H2O + CO2
pH>8,3 pH = 3
Перша фаза реакції проходить у присутності індикатору фенолфталеїну, який у лужному середовищі (pH>8,3) забарвлює воду у рожевий колір. Тітруючи цей розчин соляною кислотою до знебарвлення, ми досягаєм такого моменту, коли вода вже не містить іону CO32-, а тільки іон HCO3-. Оскільки іон CO32- визначається по індикатору фенолфталеїну тільки наполовину (до форми HCO3-), то для визначення загальної кількості карбонатного іону, об‘єм витраченої на тітрування кислоти треба подвоїти.
Подальше тітрування води соляною кислотою проходить по другій фазі реакції, для якої індикатором є метиловий оранжевий. Він забарвлює воду у жовтий колір, а при pH=3 переходить у рожевуватий (персиковий) колір. При розрахунку вмісту HCO3-, первісно присутнього у воді треба із загальної кількості мілілітрів соляної кислоти, витрачених на титрування води з метиловим оранжевим, відняти кількість мілілітрів соляної кислоти, витрачених на титрування води з фенолфталеїном.
Необхідні хімічні реактиви та обладнання:
1% розчину фенолфталеїну
5 % розчин соляної кислоти
індикатор метиловий оранжевий
конічна колба місткістю 200мл
[CO32-] Х і д а н а л і з у. Відміряти піпеткою 50 мл досліджуваної води у конічну колбу, додати 4 краплі 1% розчину фенолфталеїну.
Якщо рідина забарвиться у рожевий колір, її тітрують соляною кислотою до знебарвлення. Відсутність рожевого забарвлення свідчить про відсутність іону CO32-.
Розрахунок [CO32-] = 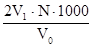 (мг-екв/л) . 30 (мг/л) де V1 – об‘єм соляної кислоти, витраченої на тітрування води з
(мг-екв/л) . 30 (мг/л) де V1 – об‘єм соляної кислоти, витраченої на тітрування води з
фенолфталеїном,мл;
N - нормальність соляної кислоти;
30 - еквівалентна вага іону CO32-;
V0 - об‘єм води, яку тітрували, мл.
В тій самій колбі, де визначали вміст CO32-, до знебарвленої рідини додати 2 краплі метилового оранжевого та тітрувати розчин соляною кислотою до переміни кольору з жовтого на рожеватий (персиковий).
Розрахунок [НCO3-] = 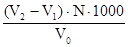 мг-екв/л . 61 (мг/л).
мг-екв/л . 61 (мг/л).
де V2 – об‘єм соляної кислоти, витраченої на титрування з метиловим оранжевим, мл;
V1 – об‘єм соляної кислоти, витраченої на титрування з фенолфталеїном, мл;
N - нормальність соляної кислоти;
V0 – об‘єм води, яку тітрували, мл;
61 - еквівалентна вага іону НCO3-.
Date: 2015-07-27; view: 515; Нарушение авторских прав