
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Хімічні властивості галогенозаміщених карбонових кислот. Підвищена рухливість галогену біля α-Карбонового атома
|
|
Галогенкарбоновые кислоты вступают в реакции, характерные для карбоновых кислот и галогензамещенных углеводородов. Взаимное влияние атома галогена и группы СООН быстро уменьшается с удалением их друг от друга. Так, кислотность снижается в ряду 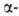 Г. к.,
Г. к., 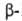 Г. к.,
Г. к., 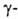 Г. к. Тригалогенуксусные кислоты легко декарбоксилируются. Карбоксильная группа сильно увеличивает способность галогена к нуклеоф. замещению: На1СН2СООН + НА -> АСН2СООН + HHal, где А = ОН, OR, NH2, SH, CN. Под действием водных растворов щелочей наряду с замещением атома галогена от
Г. к. Тригалогенуксусные кислоты легко декарбоксилируются. Карбоксильная группа сильно увеличивает способность галогена к нуклеоф. замещению: На1СН2СООН + НА -> АСН2СООН + HHal, где А = ОН, OR, NH2, SH, CN. Под действием водных растворов щелочей наряду с замещением атома галогена от 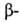 Г. к. отщепляется HHal, например: RCH(Hal)CH2COOH -> RCH=CHCOOH + HHal. При гидролизе
Г. к. отщепляется HHal, например: RCH(Hal)CH2COOH -> RCH=CHCOOH + HHal. При гидролизе 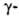 Г. к. и
Г. к. и 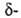 Г. к. образуются лактоны. например:,
Г. к. образуются лактоны. например:,
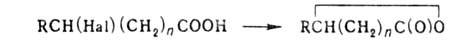
где n=2,3
Эфиры 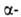 Г. к. при взаимод. с карбонильными соед. в присутствии сильных оснований превращ. в эфиры глицидных кислот (р-ция Дарзана), в присутствии Zn - в эфиры
Г. к. при взаимод. с карбонильными соед. в присутствии сильных оснований превращ. в эфиры глицидных кислот (р-ция Дарзана), в присутствии Zn - в эфиры 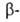 гидроксикарбоновых к-т (р-ция Реформатского), например:
гидроксикарбоновых к-т (р-ция Реформатского), например:
 галогенкарбоновые кислоты и их производные присоединяются к непредельным соед. в присутствии трет-бутилпероксида: На1СН2СООН + RCH=CH2 -> RCH2CH2CH(Hal)COOH, а также вступают с ними в реакцию теломеризации.
галогенкарбоновые кислоты и их производные присоединяются к непредельным соед. в присутствии трет-бутилпероксида: На1СН2СООН + RCH=CH2 -> RCH2CH2CH(Hal)COOH, а также вступают с ними в реакцию теломеризации.
Галогенокарбоновые кислоты более сильные кислоты, чем карбоновые. Введение галогенов в молекулу увеличивает силу кислот. Сила кислот зависит от величины дробного положительного заряда на атоме углерода карбоксильной группы. А величина 6+ увеличивается с введением галогенов, которые обладают отрицательным индуктивным эффектом.
Например, трихлоруксусная кислота по силе приравнивается к серной кислоте. Значит, сила кислоты зависит от количества атомов галогена в углеродном радикале. Кроме того, сила кислоты зависит от положения галогена в цепи. Поскольку индуктивное смешение эффективно на протяжении четырех — пяти G-связей,галогенокарбоновые кислоты более сильные, чем?-, a?— сильнее, чем у-галогенокарбоновые кислоты.
Для галогенокарбоновых кислот характерны реакции по карбоксильной группе и реакции с участием атома галогена.
По карбоксильной группе они образуют все функциональные производные карбоновых кислот: соли, сложные эфиры, ангидриды, галогенангидриды, амиды и др. Алифатические галогенокарбоновые кислоты, подобно галогеналканам, вступают в реакции замещения галогена по механизму нуклеофильного замещения. Причем, подвижность галогена зависит от взаимного расположения галогена и карбоксильной группы. Карбоксильная группа, как электроакцепторная группа, увеличивает подвижность атома галогена в молекуле. Галоген в положении менее подвижен, а положении влияние карбоксильной группы практически не сказывается.
Галогенокарбоновые кислоты находят широкое применение для получения окси- и аминокислот, широко используются в органическом синтезе лекарственных препаратов, бромизовалериановой кислоты — бромизовал — это снотворный препарат.
Номенклатура, ізомерія і способи добування гідроксикислот. Хімічні властивості гідроксикислот як біфункціональних сполук. Відношення α,β,γ-гідроксикислот до нагрівання. Якісна реакція на α-гідроксикислоти.
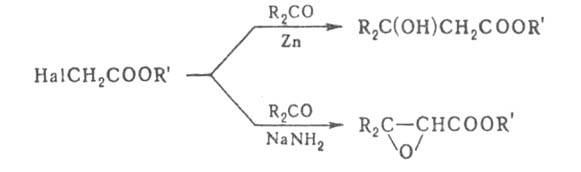
Гидроксикислоты — это производные карбоновых кислот в молекуле которых помимо карбоксильной группы содержится одна или несколько гидроксильных групп. Для них вводятся понятия основность и атомность. Основность определяется числом карбоксильных групп в молекуле, а атомность — общим числом гидроксильных групп, включая гидроксильную группу карбоксила. Для названия гидроксикислот наряду с заместительной номенклатурой широко применяются тривиальные названия. По заместительной номенклатуре ИЮПАК за родоначальную структуру принимается кислота, а положение гидроксильной группы в молекуле обозначают буквами греческого алфавита или цифрами.
По положению гидроксильной группы относительно карбоксильной гидрокислоты делятся на альфа, бета и гамма и т. д.
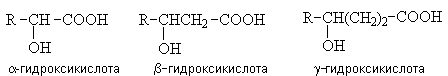
Общие методы получения.
1) Гидролиз галогензамещенных кислот.
2) Взаимодействие аминокислот с азотистой кислотой.
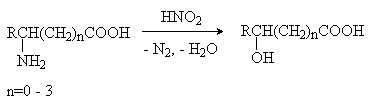
3) Восстановление оксокислот.
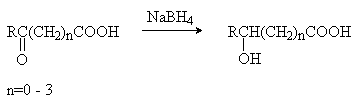
4) Присоединение воды к непредельным кислотам.
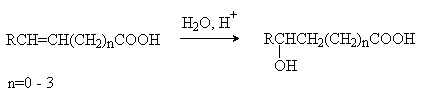
Отношение гидроксикислот к нагреванию.
Превращения гидроксикислот при нагревании определяются возможностью образования термодинамически стабильных 5-ти- 6-тичленных циклов
a -Гидроксикислоты вступают в реакцию межмолекулярного самоацилирования. При этом образуются циклические сложные эфиры – лактиды.
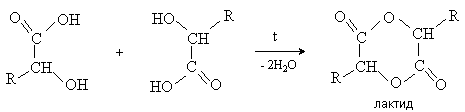
b -Гидроксикислоты при нагревании переходят a,b -непредельные кислоты.
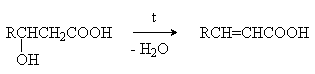
g - иd -Гидроксиокислоты претерпевают внутримолекулярное ацилирование с образованием циклических сложных эфиров – лактонов.
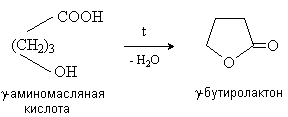
Специфические реакции a -гидроксикислот.
a -Гидроксикислоты образуют хелатные комплексы с ионами переходных металлов (Cu2+, Fe3+ и др.), которые содержат металл в составе устойчивого 5-тичленного цикла.
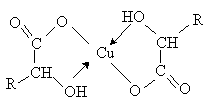
В присутствии минеральных кислот a -гидроксикислоты разлагаются с образованием муравьиной кислоты и соответствующего альдегида.
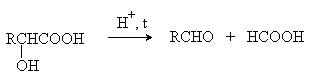
Date: 2015-07-27; view: 1019; Нарушение авторских прав