
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химические свойства карбоновых кислот
|
|
Большинство реакций карбоновых кислот может быть отнесено к одному из четырех основных типов:
1.Реакции, сопровождающиеся разрывом О-Н-связей, например, кислотная диссоциация.
2.Реакции по карбонильному углероду, которые имеют нуклеофильный характер.
3.Реакции расщепления
4.Реакции по a -углеродному атому алкильной группы.
Кислотность карбоновых кислот
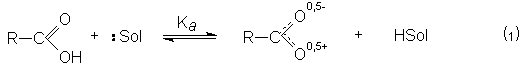 По сравнению со спиртами карбоновые кислоты обладают более высокой кислотностью. При этом в растворе реализуется равновесие.
По сравнению со спиртами карбоновые кислоты обладают более высокой кислотностью. При этом в растворе реализуется равновесие.
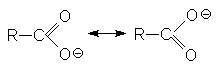 Способность к отдаче к протонам обусловлена двумя факторами: поляризацией связей О-Н в исходном состоянии и стабилизацией карбоксилат-аниона из-за деколализации отрицательного заряда в нем посредством резонанса.
Способность к отдаче к протонам обусловлена двумя факторами: поляризацией связей О-Н в исходном состоянии и стабилизацией карбоксилат-аниона из-за деколализации отрицательного заряда в нем посредством резонанса.
Кислотность карбоновых кислот характеризуется константой кислотности Ка или показателем рКа. Их значения обычно составляет приблизительно 10-5, что свидетельствует о слабости этих кислот. Присутствие в структуре радикала электроноакцепторных заместителей будет стабилизировать карбоксилат анион, что приведет к увеличению кислотности соответствующей ему кислоты. Например: рКа монохлоруксусной кислоты составляет 2,9 а уксусной – 4,8. По мере удаления электроноакцепторного заместителя от карбоксильной группы кислотность снижается, что связано с быстрым затуханием индуктивного эфекта: так рКа b -хлорпропионовой кислоты составляет ~4,0. Наоборот, увеличение разветвления алкильного радикала приводит к снижению кислотности, так как при этом возрастает индуктивный эффект алкильной группы.
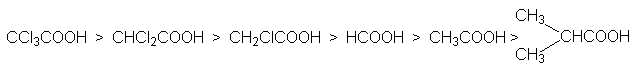 На основе этих данных можно представить следующие ряды кислотности карбоновых кислот.
На основе этих данных можно представить следующие ряды кислотности карбоновых кислот.
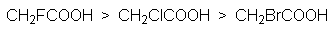
Кислотность карбоновых кислот проявляется в взаимодействии с активными металлами и основаниями.
2RCOOH + 2Na ® 2RCOONa + H2
RCOOH + NaOH ® RCOONa + H2O
2RCOOH + Na2CO3 ® 2RCOONa + H2O + CO2
На силу карбоновых кислот оказывает влияние структура углеводородного радикала и природа заместителей в нем. Электроно-донорные заместители дестабилизируют карбоксилат-ион и ослабляют кислотные свойства. Электроноакцепторные заместители за счет эффекта способствуют лелокализации отрицательного заряда в карбоксилат-ионе, повышая его устойчивость, что приводит к повышению кислотных свойств.
Образование солей. При взаимодействии с активными металлами, основными оксидами, гидроксидами и карбонатами щелочных мета-лов карбоновые кислоты образуют соли.
Взаимодействие с гидрокарбонатом натрия является простейшей качественной реакцией на карбоксильную группу.
Основность карбоновых кислот
В кислой среде (pH<3) диссоциация карбоновых кислот практически не происходит, так как равновесие (1) существенно смещено в левую сторону из-за избытка ионов HSolÅ. В то же время в кислой среде осуществляется протонирование карбоновых кислот по основному карбонильному кислороду.
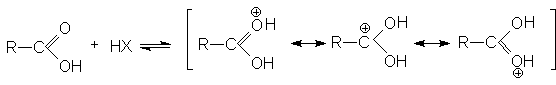
В протонированной форме оба кислородных атомов становятся одинаковыми:
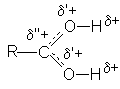
Несмотря на малую концентрацию протонированной формы присутствие небольших количеств сильных кислот исключительным образом влияет на реакционную способность карбоновых кислот: повышение положительного заряда на карбонильном углероде делает его восприимчивым к атаке нуклеофильными реагентами и открывает возможность для протекания многих реакций нуклеофильного замещения карбоновых кислот.
Date: 2015-07-27; view: 684; Нарушение авторских прав