
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Хімічні властивості фенолу. Реакції по гідроксильній групі та бензеновому ядру. Вплив фенольного гідроксилу на реакційну здатність бензенового ядра. Якісні реакції
|
|
· Обладает слабыми кислотными свойствами, при действии щелочейобразует соли — феноляты (например, фенолят натрия - C6H5ONa):
C6H5OH + NaOH = C6H5ONa + H2O
· Вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп, увеличивает реакционную способность кольца к этим реакциям, и направляет замещение в орто- и пара-положения. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
· Реакция Кольбе-Шмидта.
· Взаимодействие с металлическим натрием:
2C6H5OH + 2Na = 2C6H5ONa + H2↑
· при действии бромной воды на фенол три атома водорода замещаются на бром, и образуется осадок 2,4,6-трибромфенола:
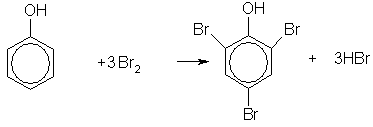
Это — качественная реакция на фенол.
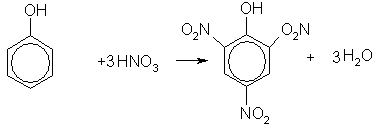
· При нитровании фенола концентрированной азотной кислотой три атома водорода замещаются на нитрогруппу, и образуется 2,4,6-тринитрофенол (пикриновая кислота):
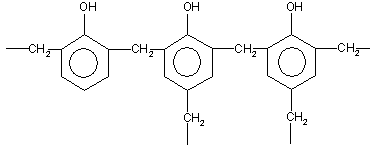
· При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации, и образуется фенолформальдегидная смола — высокомолекулярное соединение с разветвленной структурой типа:
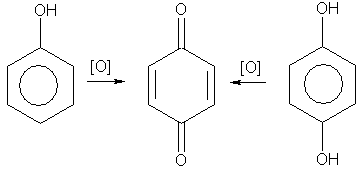
· 4. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
 (3)
(3)
· Взаимодействие с концентрированной азотной кислотой:
C6H5OH + 3HNO3конц → C6H2(NO2)3OH + 3H2О образуется 2,4,6 тринитрофенол
· Взаимодействие с хлоридом железа(III) (качественная реакция на фенол[1]):
6C6H5OH + FeCl3 → [Fe(C6H5OH)6]Cl3 образуется трихлоридфенолят железа (III)(фиолетовое окрашивание)
Как известно, гидроксильная группа -OH является заместителем I рода, то есть она способствует повышению электронной плотности в бензольном кольце (особенно в орто- и пара -положениях). Это обусловлено тем, что одна из неподелённых пар электронов атома кислорода OH-группы вступает в сопряжение с π-системой бензольного кольца. Смещение неподелённой пары электронов атома кислорода в сторону бензольного кольца приводит к увеличению полярности связи O-H. Таким образом, имеет место взаимное влияние атомов и атомных групп в молекуле фенола. Это взаимное влияние отражается в свойствах фенола.[1]
Во-первых, повышается способность к замещению атомов водорода в орто- и пара- положениях бензольного ядра, и в результате реакций замещения обычно образуются три-замещённые производные фенола.
Во-вторых, увеличение полярности связи O-H под действием бензольного ядра и появление достаточно большого положительного заряда на атоме водорода приводит к тому, что молекулы фенола диссоциируют в водных растворахпо кислотному типу.
Date: 2015-07-27; view: 1077; Нарушение авторских прав