
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Расчетные формулы
|
|
Нижний концентрационный предел распространения пламени φн определяют по предельной теплоте сгорания. Установлено, что 1 м3 различных газовоздушных смесей на НКПР выделяет при горении постоянное среднее количество тепла - 1830 кДж, называемое предельной теплотой горения. Следовательно,
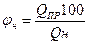 (2.1.1)
(2.1.1)
если принять среднее значение Qпр. равным 1830 кДж/м3, то φн 6удет равно
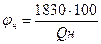 (2.1.2)
(2.1.2)
где Qн - низшая теплота сгорания горючего вещества, кДж/м3.
Нижний и верхний КПР пламени могут быть определены по аппроксимационной формуле
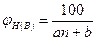 (2.1.3)
(2.1.3)
где n - стехиометрический коэффициент при кислороде в уравнении химической реакции; а и b эмпирические константы, значение которых приведены в табл. 2.1.1
Таблица 2.1.1.
| Концентрационные пределы распространения пламени | Значения коэффициента, | |
| а | b | |
| Нижний предел | 4,342 | 4,679 |
| Верхний предел n≤15 n>15 | 0,775 0,384 | 0,560 6,554 |
Концентрационные пределы распространения пламени паров жидких и твердых веществ могут быть рассчитаны, если известны температурные пределы
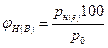 (2.1.4)
(2.1.4)
где рн(е) - давление насыщенного пара вещества при температуре, соответствующей
нижнему (верхнему) пределу распространения пламени, Па;
pо -давление окружающей среды, Па.
Давление насыщенного пара может быть определено по уравнению Антуана или по табл. 13 приложения
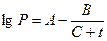 (2.1.5)
(2.1.5)
где А, В, С - константы Антуана (табл. 7 приложения);
t - температура, 0С, (температурные пределы)
Для расчета концентрационных пределов распространения пламени смесей горючих газов используют правило Ле-Шателье
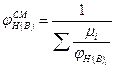 (2.1.6)
(2.1.6)
где  нижний (верхний) КПР пламени смеси газов, % об.;
нижний (верхний) КПР пламени смеси газов, % об.;
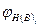 - нижний (верхний) предел распространения пламени i-ro горючего газа %, об.;
- нижний (верхний) предел распространения пламени i-ro горючего газа %, об.;
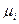 - мольная доля i-ro горючего газа в смеси.
- мольная доля i-ro горючего газа в смеси.
Следует иметь при этом в виду, что ∑μi=1, т.е. концентрация горючих компонентов газовой смеси принимается за 100%.
Если известны концентрационные пределы распространения пламени при температуре Т1, то при температуре Т2. они вычисляются по формулам
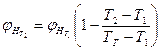 , (2.1.7)
, (2.1.7)

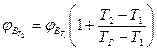 , (2.1.8)
, (2.1.8)
где 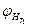 ,
, 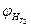 - нижний концентрационный предел распространения пламени соответственно при температурах
- нижний концентрационный предел распространения пламени соответственно при температурах
Т2. и Т1; 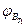 и
и 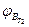 - верхний концентрационный предел распространения пламени соответственно при температурах Т1 и Т2;
- верхний концентрационный предел распространения пламени соответственно при температурах Т1 и Т2;
ТГ - температура горении смеси.
Приближенно при определении НКПР пламени Тг принимают 1550 К, при определении ВКПР пламени -1100К.
При разбавлении газовоздушной смеси инертными газами (N2, СО2 Н2О пары и т.п.) область воспламенения сужается: верхний предел снижается, а нижний - возрастает. Концентрация инертного газа (флегматизатора), при которой нижний и верхний пределы распространения пламени смыкаются, называется минимальной флегматизирующей концентрацией φф. Содержание кислорода такой системе называют минимальным взрывоопасным содержанием кислорода МВСК. Некоторое содержание кислорода ниже МВСК называют безопасным 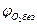 .
.
Расчет указанных параметров проводят по формулам
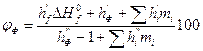 (2.1.9)
(2.1.9)
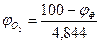 (2.1.10)
(2.1.10)
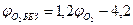 (2.1.11)
(2.1.11)
где 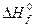 - стандартная теплота образования горючего, Дж/моль;
- стандартная теплота образования горючего, Дж/моль;
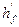 ,
, 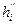 ,
, 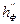 - константы, зависящие от вида химического элемента в молекуле горючего и вида флегматизатора, табл. 14 приложения;
- константы, зависящие от вида химического элемента в молекуле горючего и вида флегматизатора, табл. 14 приложения;
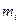 - количество атомов i-го элемента (структурной группы) в молекуле горючего.
- количество атомов i-го элемента (структурной группы) в молекуле горючего.
Пример 1. По предельной теплоте сгорания определись нижний концентрационный предел воспламенения бутана в воздухе.
Решение. Для расчета по формуле (2.1.1) в табл. 15 приложения находим низшую теплоту сгорания вещества 2882,3 кДж/моль. Эту величину надо перевести в другую размерность - кДж/м3:
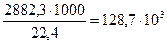 кДж/м3
кДж/м3
По формуле (2.1.1) определим нижний концентрационный предел распространения пламени (НКПР)
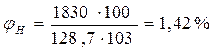
По табл. 13 приложения находим, что экспериментальное значение 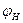 - 1,9%. Относительная ошибка расчета, следовательно, составила
- 1,9%. Относительная ошибка расчета, следовательно, составила
.
Пример 2. Определить концентрационные пределы распространения пламени этилена в воздухе.
Решение.
Расчёт КПР пламени проводим по аппроксимационной формуле. Определяем значение стехиометрического коэффициента при кислороде
С3Н4+3О2 = 2СО2+2Н2О
Таким образом, n = 3, тогда
Определим относительную ошибку расчета. По табл. 13 приложения экспериментальные значения пределов составляют 3,0-32,0:
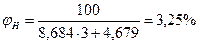
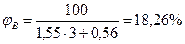
Следовательно, при расчете НКПР этилена результат завышен на 8%, а при расчете НКПР - занижен на 40%.
Пример 3. Определим, концентрационные пределы распространения пламени насыщенных паров метанола в воздухе, если известно, что его температурные пределы составляют 280 - 312 К. Атмосферное давление нормальное.
Решение.
Для расчета по формуле (2.1.4) необходимо определить давление насыщенных паров, соответствующее нижнему (7°С) и верхнему (39оС) пределам распространения пламени.
По уравнению Антуана (2.1.5) находим давление насыщенного пара, воспользовавшись данными табл.7 приложения.
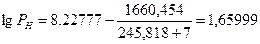
РН=45,7 мм.рт.ст=45,7·133,2=6092,8 Па
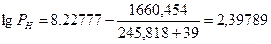
РН=250 мм.рт.ст=250·133,2=33300 Па
По формуле (2.1.3) определим НКПР

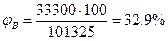
Пример 4. Определить концентрационные пределы распространения пламени газовой смеси, состоящей 40% пропана, 50% бутана и 10% пропилена.
Решение.
Для расчета КПР пламени смеси газов но правилу Ле-Шателье (2.1.6) необходимо определить КПР пламени индивидуальных горючих веществ, методы расчета которых рассмотрены выше.
С3Н8-2,1÷9,5%; С3Н6-2,2÷10,3%; С4Н10-1,9÷9,1%
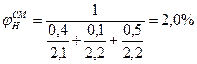
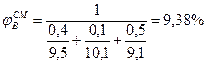
Пример 5. Каково минимальное количество диэтилового эфира, кг, способное при испарении в ёмкости объёмом 350 м3 сосдать взрывоопасную концетрацию.
Решение.
Концентрация будет взрывоопасной, если φн=φпг где (φпг - концентрация паров горючего вещества). Расчетом (см. примеры 1-3 данного раздела) пли по табл. 5 приложения находим НКПР пламени диэтилового эфира. Он равен 1,7%.
Определим объем паров диэтилового эфира, необходимый для создания в объеме 350 м3 этой концентрации
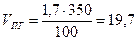 м3
м3
Таким образом, для создания НКПР диэтилового эфира о объеме 350 м3 необходимо ввести 5,95 м3 его паров. Принимая во внимание, что 1 кмоль (74 kг) пара, приведенный к нормальным условиям, занимает объем, равный 22,4 м1, находим количество диэтилового эфира
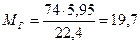 кг
кг
Пример 6. Определить, возможно ли образование взрывоопасной концентрации в объеме 50 м3 при испарении 1 кг гексана, если температура окружающей среды 300 К.
Решение.
Очевидно, паровоздушная смесь будет взрывоопасной, если φн≤φпг≤φв - При 300 К объем паров гексана, образующийся в результате испарения 5 кг вещества, найдем, принимая во внимание, что при испарении 1 кмоля (86 кг) гексана при 273 К объем паровой фазы будет равен 22,4 м3
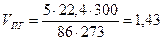 м3
м3
Концентрация паров гексана в помещении объёмом 50м3, следовательно, будет равна
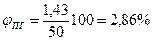
Определив концентрационные пределы распространения пламени гексана в воздухе (1,2-7,5%), по таблицам или расчетом устанавливаем, что образующаяся смесь является взрывоопасной.
Пример 7. Определить, образуется ли взрывоопасная концентрация насыщенных паров над поверхностью резервуара, содержащего 60% диэтилового эфира (ДЭ) и 40% этилового спирта (ЭС), при температуре 245 К?
Решение.
Концентрация паров будет взрывоопасной, если φсмн≤φсмнп≤φсмв (φсмнп - концентрации насыщенных паров смеси жидкостей).
Очевидно, что в результате различной летучести веществ состав газовой фазы будет отличаться от состава конденсированной фазы. Содержание компонентов в газовой фазе по известному составу жидкой определим по закону Рауля для идеальных растворов жидкостей.
1. Определим мольный состав жидкой фазы
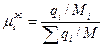 ,
,
где 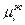 - мольная доля i-го вещества;
- мольная доля i-го вещества;
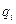 - весовая доля i-го вещества;
- весовая доля i-го вещества;
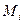 - молекулярная масса i-го вещества; (МДЭ =74, МЭС =46)
- молекулярная масса i-го вещества; (МДЭ =74, МЭС =46)
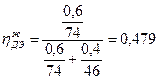
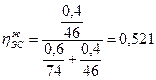
2. По уравнению (2.1.5), используя значения табл.12 приложения. Находим давление насыщенного эфира и этилового спирта при температуре 19°С (245 К)
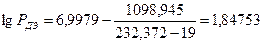
РДЭ =70,39 мм.рт.ст=382,6 Па
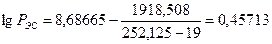
РЭС =2,87 мм.рт.ст=382,6 Па
3.Согласно закону Рауля, парциальное давление насыщенных паров i-й жидкости над смесью равно произведению давления насыщенного пара над чистой жидкостью на ее мольную долю в жидкой фазе, т.е.
РДЭ(пар )=9384,4·0,479=4495,1 Па;
РЭС(пар) =382,6·0,521=199,3 Па.
4.Приняв сумму парциальных давлений насыщенных паров диэтилового эфира и этилового спирта равной 100%, определим
а) концентрацию паров в воздухе
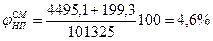
б) мольный состав газовой фазы (закон Рауля-Дуартье)

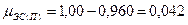
5. Определив расчетом или по справочным данным (табл.16 приложения) КПР пламени индивидуальных веществ (диэтиловый эфир 1,7÷59%, этиловый спирт 3,6÷19%). по правилу Ле-Шагелье рассчитаем КПР пламени паровой фазы
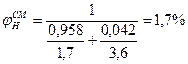
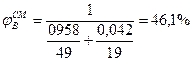
6. Сравнивая полученные в п.4,а концентрацию паровоздушной смеси с концентрационными пределами распространения пламени (1,7-46,1%), делаем заключение, что при 245 К над данной жидкой фазой образуется взрывоопасная концентрация насыщенных паров в воздухе.
Пример 8. Рассчитать безопасную концентрацию кислорода при разбавлении углекислым газом смеси паров ацетона в воздухе.
Решение.
По табл.15 приложения находим теплоту образования ацетона 248,1·103 Дж/моль. Из химической формулы ацетона (С3Н6О) следует, что тс= 3, тн= 6, то= 1. Значения остальных параметров, необходимые для расчета по формуле (2.8), выбираем из табл. 11 для двуокиси углерода
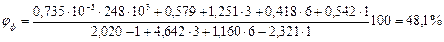
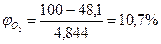
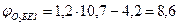
Следовательно, при снижении концентрации кислорода в четырехкомпонентной системе, состоящей из паров ацетона, двуокиси углерода, азота и кислорода, до 8,6% смесь становится взрывобезопасной. При содержании же кислорода, равном 10,7% эта смесь будет предельной по взрываемости. Согласно справочным данным (справочник "Пожарная опасность веществ и материалов, применяемых в химической промышленности". - М,, Химия, 1979), МВСК ацетоновоздушной смеси при разбавлении ее двуокисью углерода составляет 14,9%. Определим относительную ошибку расчета
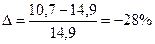
Таким образом, результаты расчета МВСК занижены на 28%.
Задание на самостоятельную работу
Задача: Рассчитать концентрационные пределы распространения пламени паров i-ro вещества в воздухе. Результаты расчета сравнить с имеющимися справочными
данными и определить относительную ошибку
| Вариант | Вещество жидкость | Вещество газ |
| Амилбензол | Ацетилен | |
| Н-Амиловый спирт | Метан | |
| Анизол | Окись углерода | |
| Анилин | Этан | |
| Бутилацетат | Водород | |
| Бутиловый спирт | Пропан | |
| Бензол | Сероводород | |
| Диэтиловый эфир | Бутан | |
| Ксилол | Ацетилен | |
| Уайт-спирит | Метан | |
| Этиленгликоль | Окись углерода | |
| Трет-Амиловый спирт | Этан | |
| Гексан | Водород | |
| Метиловый спирт | Пропан | |
| Толуол | Сероводород | |
| Стирол | Бутан | |
| Пентан | Метан | |
| Этанол | Этан | |
| Амилметилкетон | Пропан | |
| Бутилбензол | Бутан | |
| Бутилвиниловый эфир | Окись углерода | |
| Ацетон | Ацетилен | |
| Этиловый спирт | Водород | |
| Гептан | Метан | |
| Октан | Ацетилен | |
| Гексан | Метан | |
| Бутиловый спирт | Окись углерода | |
| Анилин | Этан | |
| Бензол | Водород | |
| Ксилол | Пропан |
Date: 2015-07-27; view: 5159; Нарушение авторских прав