
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Коэффициент избытка воздуха
|
|
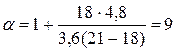
Объём воздуха, участвующего в процессе горения 1 м3 аммиака, определим из формулы (1.1.7)
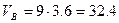 м3/м3.
м3/м3.
Пример 7. Определить объём окислительной среды, состоящей из 60% О2 и 40% N2, необходимый для горения 1 кг изоприлового спирта, если её температура равна 295 К, давление 62,0 кПа.
Решение.
Так как окислительная среда отличается по составу от воздуха, определим по формуле (1.1.1) объёмное соотношение кислорода и азота 40:60=0,67.
Уравнение реакции горения изоприлового спирта
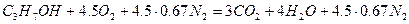
Теоретический объём окислительной среды при нормальных условиях рассчитаем по формуле (1.1.3,б). Молекулярная масса горючего равна 60,
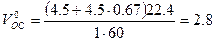 м3/кг.
м3/кг.
Объём окислительной среды при заданных условиях горения определим из формулы (1.1.6)
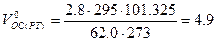 м3/кг.
м3/кг.
Пример 8. Определить массу динитротолуола, сгоревшего в герметичном объёме 100м3, если содержание кислорода в продуктах горения составило 12%.
Решение.
Так как в продуктах горения содержится кислород, то горение протекало в избытке воздуха, коэффициент избытка определим по формуле(1.1.10).
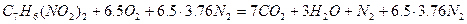 .
.
Молекулярная масса горючего равна 183. Теоретический объём воздуха
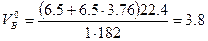 м3/кг.
м3/кг.
Теоретический объём продуктов горения (формула 1.1.15)
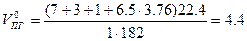 м3/кг,
м3/кг,
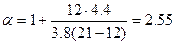 .
.
Практический объём воздуха, пошедший на горение
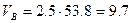 м3/кг.
м3/кг.
Тогда массу сгоревшего динитротолуола Мг определим из соотношения
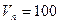 м3- полный объём помещения
м3- полный объём помещения
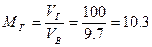 кг.
кг.
Задание на самостоятельную работу
Задача: Рассчитать теоретически необходимое количество воздуха для
сгорания m кг вещества при Т=... и Р=.... (жидкость)
| Вариант | Вещество | m, кг | Т, оС | Р, мм рт.ст. |
| Амилбензол | -20 | |||
| Н-Амиловый спирт | ||||
| Анизол | -15 | |||
| Анилин | ||||
| Бутилацетат | -10 | |||
| Бутиловый спирт | ||||
| Бензол | -5 | |||
| Диэтиловый эфир | ||||
| Ксилол | -18 | |||
| Уайт-спирит | ||||
| Этиленгликоль | -16 | |||
| Трет-Амиловый спирт | ||||
| Гексан | -14 | |||
| Метиловый спирт | ||||
| Толуол | -12 | |||
| Стирол | ||||
| Пентан | -8 | |||
| Этанол | ||||
| Амилметилкетон | -6 | |||
| Бутилбензол | ||||
| Бутилвиниловый эфир | -4 | |||
| Ацетон | ||||
| Этиловый спирт | -2 | |||
| Гептан | ||||
| Октан | -25 | |||
| Гексан | 1,5 | |||
| Бутиловый спирт | -6 | |||
| Анилин | 4,6 | |||
| Бензол | -11 | |||
| Ксилол | ||||
| Анизол | -16 | |||
| Диэтиловый эфир | ||||
| Бутиловый спирт | ||||
| Этиловый спирт | -4 | |||
| Бензол | -8 | |||
| Ксилол | ||||
| Ацетон | ||||
| Этиловый спирт | -4 | |||
| Гептан | ||||
| Октан | -20 |
Задача: Рассчитать теоретически необходимое количество воздуха для
сгорания V м3 горючего газа
| Вариант | Горючий газ | V, м3 |
| Ацетилен | ||
| Метан | ||
| Окись углерода | ||
| Этан | ||
| Водород | ||
| Пропан | ||
| Сероводород | ||
| Бутан | ||
| Ацетилен | ||
| Метан | ||
| Окись углерода | ||
| Этан | ||
| Водород | ||
| Пропан | ||
| Сероводород | ||
| Бутан | ||
| Метан | ||
| Этан | ||
| Пропан | ||
| Бутан | ||
| Окись углерода | ||
| Ацетилен | ||
| Водород | ||
| Метан | ||
| Ацетилен | ||
| Метан | ||
| Окись углерода | ||
| Этан | ||
| Водород | ||
| Пропан | 1,5 | |
| Сероводород | ||
| Бутан | ||
| Ацетилен | ||
| Метан | ||
| Окись углерода | ||
| Этан | ||
| Водород | ||
| Пропан | ||
| Ацетилен | ||
| Водород |
1.2. Расчёт объёма и состава продуктов горения
С целью упрощения расчёта все горючие вещества разделены на три типа: индивидуальные, сложные, смеси горючих газов (табл. 1.2.1).
Таблица 1.2.1
| Тип горючего вещества | Расчетные формулы | Размерность |
| Индивидуальное вещество | 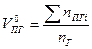 (1.2.1) (1.2.1)
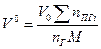 (1.2.2) (1.2.2)
| 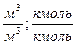
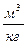
|
| Вещество сложного состава | 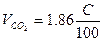 (1.2.3) (1.2.3)
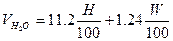 (1.2.4) (1.2.4)
 (1.2.5) (1.2.5)
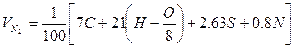 (1.2.6) (1.2.6)
| 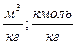
|
| Смесь газов | 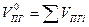 (1.2.7) (1.2.7)
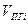  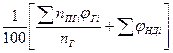 (1.2.8) (1.2.8)
| 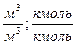
|
Здесь 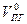 -теоретический объём продуктов горения;
-теоретический объём продуктов горения; 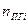 -количество i-го продукта горения в уравнении реакции, кмоль;
-количество i-го продукта горения в уравнении реакции, кмоль; 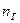 -количество горючего, кмоль;
-количество горючего, кмоль; 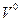 -объём 1 кмоля газа;
-объём 1 кмоля газа; 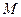 -молекулярная масса горючего;
-молекулярная масса горючего; 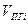 -объём i-го продукта реакции; C, H, S, O, N –содержание соответствующих элементов (углерода, водорода, серы, кислорода и азота) в горючем веществе, % вес;
-объём i-го продукта реакции; C, H, S, O, N –содержание соответствующих элементов (углерода, водорода, серы, кислорода и азота) в горючем веществе, % вес;  -содержание i-го горючего компонента в газовой смеси, %об.;
-содержание i-го горючего компонента в газовой смеси, %об.; 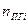 - содержание i-го негорючего компонента в составе газовой смеси, % об.
- содержание i-го негорючего компонента в составе газовой смеси, % об.
Практический (полный) объём продуктов горения состоит из теоретического объёма продуктов горения и избытка воздуха
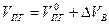 (1.2.9)
(1.2.9)
или

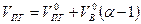 (1.2.10)
(1.2.10)
Состав продуктов горения, т.е. содержание i-го компонента определяется по формуле
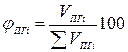 (1.2.11)
(1.2.11)
где 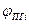 - содержание I - го компонента в продуктах сгорания, % об.;
- содержание I - го компонента в продуктах сгорания, % об.;
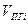 - объём I - го компонента, м3, кмоль;
- объём I - го компонента, м3, кмоль;
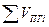 - полный объём продуктов горения, м3, кмоль.
- полный объём продуктов горения, м3, кмоль.
При горении в избытке воздуха в продуктах горения содержится кислород и азот
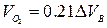 (1.2.12)
(1.2.12)
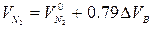 (1.2.13)
(1.2.13)
где 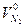 -теоретический объём азота в продуктах горения, м3, кмоль.
-теоретический объём азота в продуктах горения, м3, кмоль.
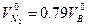 (1.2.14)
(1.2.14)
Date: 2015-07-27; view: 2323; Нарушение авторских прав