
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры. Пример 1. определить теоретическую массу и объём воздуха, необходимого для сгорания 1 м3 метана при нормальных условиях
|
|
Пример 1. определить теоретическую массу и объём воздуха, необходимого для сгорания 1 м3 метана при нормальных условиях.
Решение.
Горючее вещество является индивидуальным химическим соединением, поэтому для расчёта его объёма надо пользоваться формулой (1.1.3,а), запишем уравнение химической реакции горения СН4 в воздухе

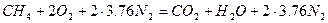 .
.
Из уравнения находим 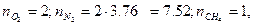 тогда
тогда
 м3/м3 или кмоль/кмоль
м3/м3 или кмоль/кмоль
По формуле (1.1.15) с учётом уравнения (1.1.16) рассчитаем массу воздуха
 кг/м3.
кг/м3.
Пример 2. Определить теоретический объём воздуха, необходимого для горения 1 кг бензола.
Решение.
Горючее – индивидуальное химическое соединение, поэтому для расчёта по формуле (1.1.3,б) запишем уравнение химической реакции горения

найдём  .
.
Молекулярная масса бензола 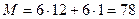 .
.
Объём 1 кмоля газа при нормальных условиях составляет 22,4 м3
 м3/кг.
м3/кг.
Пример 3. Определить объём и массу воздуха, необходимого для горения 1 кг органической массы состава С – 60%, Н – 5%, О – 25%, N – 5%, W – 5%(влажность), если коэффициент избытка воздуха  ; температура воздуха 305 К, давление 99500 Па.
; температура воздуха 305 К, давление 99500 Па.
Решение.
Так как горючее вещество сложного состава, то теоретическое количество воздуха при нормальных условиях определим по формуле (1.1.4)
 м3/кг.
м3/кг.
Из формулы (1.1.7) рассчитаем практическое количество воздуха при нормальных условиях
 м3/кг.
м3/кг.
Находи количество воздуха, пошедшего на горение веществ при заданных условиях горения. Используя формулу (1.1.6), получим
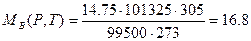 м3/кг,
м3/кг,
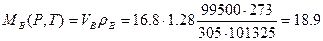 кг/кг.
кг/кг.
Пример 4. Определить объём воздуха, необходимого для горения 5 м смеси газов, состоящих из 20% - СН4; 40% - С2Н2; 10% - СО; 5% - N2 и 25% - O2, если коэффициент избытка воздуха 1,8.
Решение.
Горючее-смесь газов, поэтому для расчёта объёма воздуха, пошедшего на горение, воспользуемся формулой (1.1.5). Для определения стехиометрических коэффициентов при кислороде  запишем уравнение реакций горения горючих компонентов в кислороде
запишем уравнение реакций горения горючих компонентов в кислороде
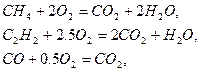
тогда
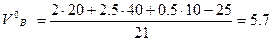 м3/м3.
м3/м3.
Для горения 5 м3 газовой смеси необходимый теоретический объём воздуха составит 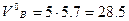 м3. Практическое количество воздуха:
м3. Практическое количество воздуха:
 м3.
м3.
Пример 5. Определить коэффициент избытка воздуха при горении уксусной кислоты, если на горение 1 кг поступило 3 м3 воздуха.
Решение.
Для определения коэффициента избытка воздуха по формуле (1.1.7) необходимо рассчитать его теоретическое количество. Молекулярная масса уксусной кислоты 60.

 м3/кг.
м3/кг.
Тогда коэффициент избытка воздуха по формуле (1.1.7) равен

Горение протекало при недостатке воздуха.
Пример 6. Определить объём воздуха, пошедшего на окисление 1 м3 аммиака, если в продуктах горения содержание кислорода составило 18%.
Решение. Определяем теоретическое количество воздуха, необходимого для горения 1 м3 аммиака:
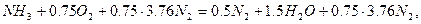
тогда
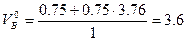 м3/м3.
м3/м3.
Для определения коэффициента избытка воздуха необходимо рассчитать теоретическое количество продуктов горения 1 м3 аммиака
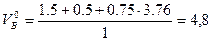 м3/м3.
м3/м3.
Date: 2015-07-27; view: 6212; Нарушение авторских прав