
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Материальный балансы процессов горения
|
|
Теоретической базой для расчётов материального и теплового балансов являются фундаментальные законы сохранения веществ и энергии.
1.1. Расчёт количества воздуха, необходимого для горения веществ
Для практических расчётов принимают, что состав воздуха состоит из 21%кислорода и 79% азота. Таким образом, объёмное соотношение азота и кислорода в воздухе составит:
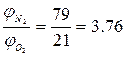 (1.1.1)
(1.1.1)
где 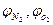 - соответственно объёмное (% об.) содержание азота и кислорода
- соответственно объёмное (% об.) содержание азота и кислорода
в окислительной среде.
Следовательно, на 1 м3 (кмоль) кислорода в воздухе приходится 3,76 м3 (кмоль) азота.
Весовое соотношение азота и кислорода в воздухе составляет 23,3% О2 и 76,7% N2. Его можно определить, исходя из:
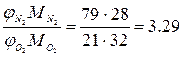 (1.1.2)
(1.1.2)
где 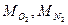 -молекулярные массы соотношение азота и кислорода.
-молекулярные массы соотношение азота и кислорода.
Для удобства расчётов горючие вещества разделяют на три типа (табл.1.1.1): индивидуальные химические соединения (метан, уксусная кислота и т.п.), вещества сложного состава (древесина, торф, сланцы, нефть, и т.п.), смесь газов (генераторный газ и т.п.).
Таблица 1.1.1
| Тип горючего вещества | Расчётные формулы | Размерность |
| Индивидуальное вещество | 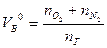 (1.1.3,а) (1.1.3,а)
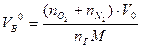 (1.1.3,б) (1.1.3,б)
| 
|
| Вещество сложного состава | 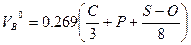 (1.1.4) (1.1.4)
| 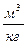
|
| Смесь газов | 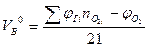 (1.1.5) (1.1.5)
| 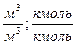
|
Здесь 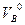 -теоретическое количество воздуха;
-теоретическое количество воздуха; 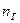 ,
, 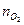 ,
, 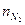 -количество горючего, кислорода и азота, получаемого из уравнения химической реакции горения, кмоль; М – молекулярная масса горючего; V0 – объем 1 кмоля газа при нормальных условиях (22,4 м3); C, H, S, O - весовое содержание соответствующих элементов в составе горючего, %
-количество горючего, кислорода и азота, получаемого из уравнения химической реакции горения, кмоль; М – молекулярная масса горючего; V0 – объем 1 кмоля газа при нормальных условиях (22,4 м3); C, H, S, O - весовое содержание соответствующих элементов в составе горючего, %  - концентрация I - го горючего компонента, % об.;
- концентрация I - го горючего компонента, % об.; 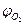 -концентрация кислорода в составе горючего газа, % об.;
-концентрация кислорода в составе горючего газа, % об.; 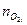 - количество кислорода, необходимое для окисления одного кмоля i- го горючего компонента, кмоль.
- количество кислорода, необходимое для окисления одного кмоля i- го горючего компонента, кмоль.
Для определения объёма воздуха при горении в условиях, отличных от нормальных, пользуются уравнением состояния идеальных газов
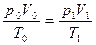 , (1.1.6)
, (1.1.6)
где 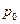 - нормальное давление, Па;
- нормальное давление, Па;
Т0 - нормальная температура, К;
V0 - объём воздуха при нормальных условиях, м3;
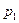 - заданное давление, Па;
- заданное давление, Па;
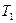 - заданная температура, К;
- заданная температура, К;
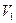 - заданный объём газа, м3.
- заданный объём газа, м3.
Практический объём воздуха Vв, поступивший в зону горения. Отношение практического объёма воздуха к теоретическому называется коэффициентом избытка воздуха 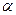 :
:
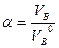 (1.1.7)
(1.1.7)
Разность между практическим и теоретическим объёмами воздуха называется избытком воздуха 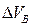 :
:
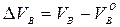 (1.1.8)
(1.1.8)
Из уравнений (1.1.7) и (1.1.8) следует, что
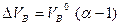 (1.1.9)
(1.1.9)
Если известно содержание кислорода в продуктах горения, то коэффициент избытка воздуха определяется по формуле:
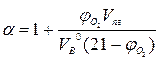 (1.1.10)
(1.1.10)
где 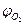 - содержание кислорода в продуктах горения, % об.;
- содержание кислорода в продуктах горения, % об.;
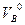 - теоретический объём продуктов горения.
- теоретический объём продуктов горения.
Для веществ у которых объём продуктов горения равен объёму исходного воздуха (например, углерод), формула (1.1.10) упрощается:
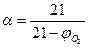 . (1.1.11)
. (1.1.11)
В случае образования продуктов неполного сгорания (CO, H2, CH4, и др.) формула (1.1.11) приобретает вид:
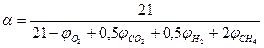 (1.1.12)
(1.1.12)
где 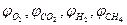 - содержание соответствующих веществ в продуктах
- содержание соответствующих веществ в продуктах
горения, % об.
Если содержание кислорода в окислительной среде отличается от содержания его в воздухе, то формулу (1.1.12) можно записать в виде:
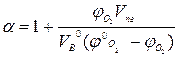 (1.1.13)
(1.1.13)
и соответственно формулу (1.1.13)
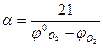 (1.1.14)
(1.1.14)
где 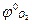 - исходное содержание кислорода в окислительной среде, % об.
- исходное содержание кислорода в окислительной среде, % об.
Часто в пожарно-технических расчётах требуется определить массу воздуха, пошедшего на горение,
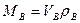 (1.1.15)
(1.1.15)
где 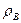 - плотность воздуха, кг/м3.
- плотность воздуха, кг/м3.
Очевидно, что
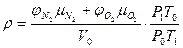 (1.1.16)
(1.1.16)
После подстановки постоянных значений в формулу (1.1.16) получим
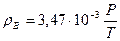 (1.1.17)
(1.1.17)
где Р – атмосферное давление, Па;
Т – температура воздуха, К.
Date: 2015-07-27; view: 1761; Нарушение авторских прав