
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Молекулярное строение вещества и газовые законы
|
|
· Количество вещества
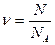 ,
,
где N – число структурных элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему); N A = 6,02∙ 1023 моль-1 – постоянная Авогадро. Единица измерения количества вещества моль (моль).
· Молярная масса вещества
 ,
,
где m – масса тела (системы); ν – количество вещества этого тела. Единица измерения молярной массы килограмм на моль (кг/моль).
· Относительная молекулярная масса вещества
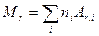 ,
,
где ni – число атомов i –го химического элемента; Аr,i – относительная атомная масса этого элемента. Относительные атомные массы приводятся в таблице Д.И. Менделеева.
· Связь молярной массы М с относительной молекулярной массой вещества
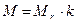 ,
,
где k = 10-3 кг/моль.
· Количество вещества смеси газов
 ,
,
или
 ,
,
где νi, mi, Mi, Ni – соответственно количество вещества, масса, молярная масса и число молекул i -го компонента смеси.
· Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева)
 или
или 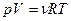 ,
,
где m – масса газа; М – молярная масса газа; Т – термодинамическая температура; R – молярная газовая постоянная; ν – количество вещества; р – давление; V – объем газа.
· Опытные газовые законы, являющиеся частными случаями уравнения Клапейрона-Менделеева:
а) закон Бойля-Мариотта (изотермический процесс: Т = const, m = const)
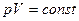 ,
,
или для двух состояний газа
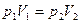 ;
;
б) закон Гей-Люссака (изобарный процесс: p = const, m = const)
 ,
,
или для двух состояний газа
 ;
;
в) закон Шарля (изохорный процесс: V = const, m = const)
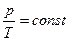 ,
,
или для двух состояний газа
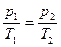 ;
;
г) объединенный газовый закон (m = const)
 или
или 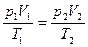 ,
,
где p 1, V 1, T 1 – давление, объем и температура газа в начальном состоянии; p 2, V 1, T 1 – те же величины в конечном состоянии.
Date: 2015-08-15; view: 595; Нарушение авторских прав