
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Физические основы термодинамики
|
|
· Первое начало термодинамики
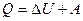 ,
,
где Q – количество теплоты, получаемое системой, Дж; А – работа, совершаемая системой против внешних сил, Дж; Δ U – изменение внутренней энергии системы, Дж.
· Первое начало термодинамики в дифференциальной форме
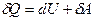 ,
,
где d U – бесконечно малое изменение внутренней энергии системы; δА – элементарная работа; δQ – бесконечно малое количество теплоты.
· Работа, совершаемая газом при изменении его объема
 .
.
Частные случаи
а) при изобарном процессе (p = const)
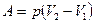 ;
;
б) при изотермическом процессе (T = const)
 ;
;
в) при изохорном процессе (V = const)
А = 0;
г) при адиабатном процессе
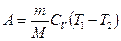 .
.
· Удельная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К
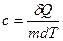 .
.
Единица измерения удельной теплоемкости джоуль на килограмм-кельвин (Дж/кг∙К).
· Молярная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К
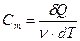 .
.
Единица измерения удельной теплоемкости джоуль на моль-кельвин (Дж/моль∙К).
· Связь между молярной C m и удельной c теплоемкостями
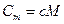 ,
,
где M – молярная масса газа.
· Молярные теплоемкости при постоянном объеме и постоянном давлении:
 ;
; 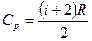 ,
,
где i – число степеней свободы; R – молярная газовая постоянная.
· Удельные теплоемкости при постоянном объеме и давлении:
 ;
;  .
.
· Уравнение Майера
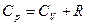 .
.
· Показатель адиабаты
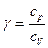 или
или  .
.
· Применение первого начала термодинамики к изопроцессам
а) к изохорному

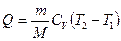 ,
, 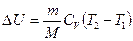 , А = 0;
, А = 0;
б) к изобарному
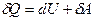
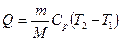 ,
, 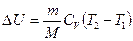 ,
, 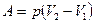 или
или 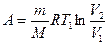 ;
;
в) к изотермическому
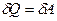
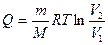 , Δ U = 0,
, Δ U = 0, 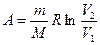 ;
;
г) к адиабатному
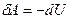
δQ = 0, 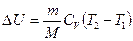 ,
, 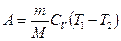 .
.
Уравнение адиабаты (уравнение Пуассона)
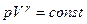 .
.
Связь между начальным и конечным значениями параметров состояний газа при адиабатном процессе
 ;
; 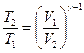 ;
; 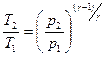 .
.
· Энтропия – функция состояния, дифференциалом которой является δQ / T
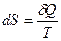 .
.
Единица измерения энтропии джоуль на кельвин (Дж/К).
Изменение энтропии
а) при обратимых процессах (в замкнутой системе)
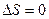 ;
;
б) при необратимых процессах (в замкнутой системе)
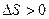 .
.
· Формула Больцмана (статистическое толкование энтропии)
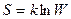 ,
,
где S – энтропия системы; W – статистический вес или термодинамическая вероятность состояния системы; k – постоянная Больцмана.
· Второе начало термодинамики: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает:
 .
.
· Третье начало термодинамики: энтропия всех тел в состоянии равновесия стремиться к нулю по мере приближения температуры к нулю Кельвина:
 .
.
· Энтальпия и ее изменение
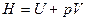 ,
,  (при p = const)
(при p = const)
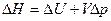 (при V = const)
(при V = const)
· Термический коэффициент полезного действия цикла в общем случае
 ,
,
где Q 1 – количество теплоты, полученное рабочим телом (газом) от нагревателя; Q 2 – количество теплоты, переданное рабочим телом охладителю.
· К.п.д. цикла Карно
 или
или 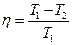 ,
,
где Т 1 – температура нагревателя; Т 2 – температура охладителя.
Date: 2015-08-15; view: 1541; Нарушение авторских прав