
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реальные газы. · Уравнение Ван-дер-Ваальса для одного моля газа
|
|
· Уравнение Ван-дер-Ваальса для одного моля газа
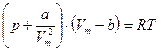 ,
,
для произвольного количества вещества
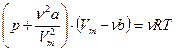 ,
,
где a и b – постоянные Ван-дер-Ваальса; V – объем, занимаемый газом; V m – молярный объем; р – давление газа на стенки сосуда; ν – количество вещества.
· Связь критических параметров – объема, давления и температуры газа – с постоянными Ван-дер-Ваальса
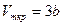 ,
, 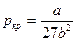 ,
, 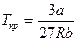 .
.
· Внутренняя энергия реального газа
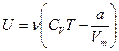 .
.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. В закрытом гараже объемом V1 = 80 м3 хранился открытый сосуд с ацетоном объемом V2 = 0.5 л, который полностью испарился. Плотность ацетона ρ = 0.8·103 кг/м3. Вентиляция в гараже отсутствует. Определить количество ацетона в 1 м3 воздуха.
Решение: Количество паров ацетона в 1 м3 воздуха равно
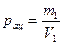 ,
,
где  - масса испарившегося ацетона.
- масса испарившегося ацетона.
Тогда
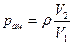 .
.
Подставив числовые данные, получим
 кг/м3.
кг/м3.
Пример 2. Сколько молекул воздуха находится в комнате объемом 240 м3 при температуре 15 0С и давлении 750 мм.рт.ст.?
Решение: Чтобы использовать объединенный закон газового состояния, сравним между собой состояния данной массы воздуха при заданных (p 1, V 1, T 1) и нормальных (p 0, V 0, T 0) условиях:
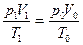 .
.
Поскольку объем воздуха при нормальных условиях 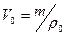 (ρ0 – плотность воздуха при нормальных условиях), то предыдущее уравнение примет вид:
(ρ0 – плотность воздуха при нормальных условиях), то предыдущее уравнение примет вид:
 ,
,
откуда  .
.
Найдем, сколько молей содержится в данной массе воздуха:
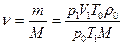 .
.
Поскольку в одном моле любого газа, в том числе и воздуха, содержится число молекул, равное постоянной Авогадро, то:
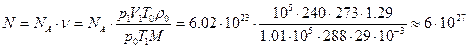 молекул.
молекул.
Пример 3. Из баллона со сжатым водородом вместимостью V = 10 л вследствие неисправности вентиля утекает газ. При температуре t 1 = 7 0С барометр показывает p = 51 атм. Показание барометра не изменилось и при температуре t 2 = 17 0С. Определите, сколько газа утекло.
Решение: Используя уравнение Клапейрона-Менделеева
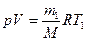 ,
,
найдем первоначальную массу водорода
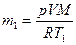 .
.
Аналогично найдем массу водорода m 2 после утечки:
 .
.
Следовательно, масса утекшего газа:
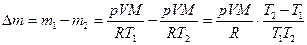
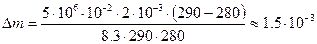 кг.
кг.
Пример 4. Давление атомарного водорода в космическом пространстве примерно р = 1,7·10-15 Па при температуре Т = 125 К, эффективный диаметр его молекул d эф = 0,22 нм. Найти, какое время t в среднем движется молекула водорода между последовательными столкновениями.
Решение: Время между последовательными столкновениями можно найти, разделив среднюю длину свободного пробега молекулы на ее среднюю арифметическую скорость:
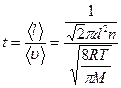 .
.
Концентрация молекул n связана с давлением р формулой  , откуда и выразим концентрацию молекул:
, откуда и выразим концентрацию молекул:  .
.
Тогда время между последовательными столкновениями молекул водорода найдем как:  .
.
Произведем вычисления
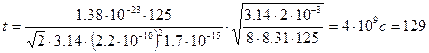 лет.
лет.
Пример 5. Кислород массой m = 2 кг занимает объем V 1 = 1 м3 и находится под давлением р 1 = 0,2 МПа. Газ был нагрет сначала при постоянном давлении до объема V 2 = 3 м3, а затем при постоянном объеме до давления р 3 = 0,5 МПа. Найти изменение внутренней энергии Δ U газа, совершаемую им работу А и теплоту Q, переданную газу.
Решение: Изменение внутренней энергии газа:
 ,
,
где i = 5 – число степеней свободы молекул кислорода; Δ Т = Т 3 – Т 1 – разность температур газа в конечном (третьем) и начальном состояниях.
Начальную и конечную температуру газа найдем из уравнения Клапейрона-Менделеева
 ,
,
откуда 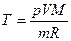 .
.
Работа расширения газа при постоянном давлении выражается формулой:
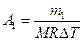 .
.
Работа газа, нагреваемого при постоянном объеме, равна нулю:
 .
.
Следовательно, полная работа, совершаемая газом, равна:
 .
.
Согласно первому началу термодинамики, теплота, переданная газу, равна сумме изменения внутренней энергии и работы:

Произведем все вычисления, учтя, что для кислорода М = 32·10-3 кг/моль.
 К;
К;  К;
К; 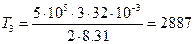 К;
К;
 Дж = 0.4 МДж;
Дж = 0.4 МДж;
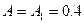 МДж;
МДж;
 Дж = 3,24МДж;
Дж = 3,24МДж;
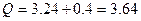 МДж.
МДж.
Пример 6. Барометр в кабине летящего самолета все время показывает одинаковое давление р = 79 кПа, благодаря чему летчик считает высоту h 1 полета неизменной. Однако температура воздуха за бортом самолета изменилась с 5 0С до 1 0С. Какую ошибку Δ h в определении высоты допустил летчик? Давление р 0 у поверхности Земли считать нормальным.
Решение: Для решения задачи воспользуемся барометрической формулой

Барометр может показывать неизменное давление при различных температурах Т 1 и Т 2 за бортом только в том случае, если самолет находится не на высоте h (которую летчик считает неизменной), а на некоторой другой высоте h 2.
Запишем барометрическую формулу для этих двух случаев:
 ,
,  .
.
Найдем отношение р 0/ р и обе части полученного равенства прологарифмируем:
 ,
, 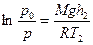 .
.
Из полученных соотношений выразим высоты h 1 и h 2 и найдем их разность:
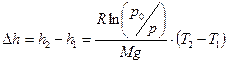
Подставим значения и произведем вычисления:
 м.
м.
Знак «–» означает, что h 2 < h 1 и, следовательно, самолет снизился на 28,5 м по сравнению с предполагаемой высотой.
Пример 8. Паровая машина мощностью N = 14,7 кВт потребляет за время t = 1 ч работы m = 8,1 кг угля с удельной теплотой сгорания q = 3,3·107 Дж/кг. Температура котла t 1 = 200 0С, температура холодильника t 2 = 58 0С. Найти фактический η ф КПД этой машины. Определить во сколько раз КПД идеальной η ид тепловой машины, работающей по циклу Карно при тех же температурах нагревателя и холодильника, превосходит КПД этой паровой машины η ф.
Решение: КПД реальной паровой машины (фактический КПД) определяется отношением работы, совершенной этой машиной за некоторое время, к количеству теплоты Q 1, которое отдано нагревателем за это время:
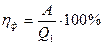 .
.
Работу, совершаемую паровой машиной, можно определить произведением мощности на время ее работы: 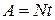 .
.
Паровая машина отдает количество теплоты Q 1, которое выделит сгоревший уголь массой m. Это количество теплоты равно:
 .
.
Тогда фактический КПД паровой машины определим как:
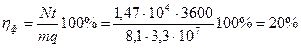 . (1)
. (1)
КПД идеальной тепловой машины, работающей по циклу Карно, определяется формулой:
 . (2)
. (2)
Разделив (2) на (1) мы ответим на второй вопрос задачи:
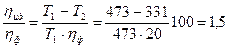 .
.
Пример 9. Какую температуру Т имеет масса m = 2г азота, занимающего объем V = 820 см3 при давлении р = 0,2 МПа? Для азота Т к = 126 K, р к = 3,4 МПа.
Решение: Реальные газы подчиняются уравнению Ван-дер-Ваальса: 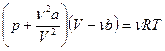 . Известно, что
. Известно, что 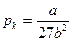 , откуда выразим a:
, откуда выразим a: 
 , подставим сюда значение для а:
, подставим сюда значение для а:  , откуда выразим b:
, откуда выразим b: 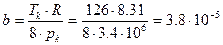 и вычислим а:
и вычислим а: 
Из уравнения Ван-дер-Ваальса температура:

Date: 2015-08-15; view: 1208; Нарушение авторских прав