
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Распределение электронов в многоэлектронных атомах. Электронные конфигурации
|
|
К В А Н Т О В Ы Е Ч И С Л А

l = 0: s-орбитали, имеют сферическую форму.
S-электроны.
l =1: р-орбитали, имеют гантелеобразную форму.
р-электроны.
l = 2: d-орбитали, имеют более сложную форму.
D-электроны.
l = 3: f- орбитали, их форма еще сложнее.
F- электроны.
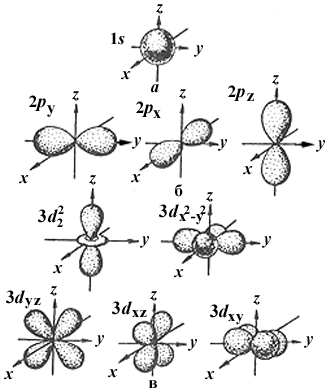
Формы электронных облаков различных атомных орбиталей и их ориентация в пространстве.
Каждый энергетический уровень расщепляется на на определенное количество подуровней:
Число подуровней на данном уровне равно номеру уровня.

| Оболочка Энергетич. уровень Значение n | Подоболочки | Значения ml | Число АО: N=n2 | |
| Буквеное обзнач. | Значение l | |||
| s | ||||
| s | ||||
| p | -1, 0, +1 | |||
| ∑4 | ||||
| s | ||||
| p | –1, 0, +1 | |||
| d | –2, –1, 0, +1, +2 | |||
| ∑9 | ||||
| s | ||||
| p | –1, 0, +1 | |||
| d | –2, –1, 0, +1, +2 | |||
| f | –3, –2, –1, 0, +1, +2, +3 | |||
| ∑16 |

Состояние любого электрона в атоме может быть полностью охарактеризовано набором из четырех рассмотренных квантовых чисел.
Распределение электронов в многоэлектронных атомах. Электронные конфигурации.
ОСНОВНЫЕ ПРИНЦИПЫ И ПРАВИЛА




| 1s | 2 s | 2 p | 3 s | 3 p | 3 d | 4 s | 4 p | |
| n+l | 1+0=1 | 2+0=2 | 2+1=3 | 3+0=3 | 3+1=4 | 3+2=5 | 4+0=4 | 4+1=5 |
| порядок |
 |
Следствия из принципа Паули:
 – на одной орбитали могут находиться не более двух электронов с разными спинами
– на одной орбитали могут находиться не более двух электронов с разными спинами
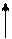
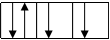 – максимальное число электронов на энергетическом подуровне: 2(2 l +1)
– максимальное число электронов на энергетическом подуровне: 2(2 l +1)
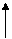
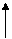

 – максимальное число электронов на энергетическом уровне: 2 n 2
– максимальное число электронов на энергетическом уровне: 2 n 2
 - вакантная (пустая) орбиталь
- вакантная (пустая) орбиталь
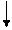
 - частично заполненная орбиталь
- частично заполненная орбиталь
(с неспаренным электроном)


 - насыщенная орбиталь (с неподеленной парой электронов)
- насыщенная орбиталь (с неподеленной парой электронов)

Пример
 |  |
3s1 n = 3 3s2 n = 3
l = 0 l = 0
ml = 0 ml = 0
ms = + 1/2 (условно) ms = -1/2, +1/2(условно)
 |
p3


p4
Date: 2015-07-24; view: 1295; Нарушение авторских прав