
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Состав газообразного топлива
|
|
СО+ Н2+ СН4+СnHm+Н2S+О2+N2+CO2=100 где газы взяты в % при норм.усл.(t=0, P=101325 Па)
Рабочий состав- состав который поступает в топку (%)
CP+HP+SP+OP+NP+AP+WP=100
Сухая масса – рабочий состав без влаги W.
CC+HC+SC+OC+NC+AC=100
Горючая масса- сухая масса без золы А.
CГ+HГ+SГ+OГ+NГ=100
По элементарному составу орг. топлива главным образом содержат С. Но есть использование бороводородного топлива в ракетной промышленности.
В дереве, торфе - 50% С, в угле - 75% С, в антрацитах - 75% С.
При полном сжигании С выделяется тепло в количестве Qс=33600 (кДж/кг)
Второй важный элемент – Н. В древесине – 6-6,5%, в нефти – 5%, в каменном угле – 4-5,5%.
Тепловая ценность Н в 4 раза > С, Qнв=141500 (кДж/кг)- с учетом конденсации, QН2Н=11900 (кДж/кг). Теплотворная способность Н – высшая.
Третий компонент – S. Нежелательный горючий элемент, бывает органическая-S0, и колчеданная-Sk (Fe+Cu+S). Qs=9000 (кДж/кг).
Сера нежелательна тем, что при низкой ее энергетической характеристики, продукты ее сгорания вредят ОС и машинным механизмам. Поэтому топливо очищают от серы.
Кислород и азот также нежелательные элементы топлива. Кислород, связующая часть горючих элементов, снижает энергетические характеристики. Азот в топливе приводит к образованию высокотоксичных оксидов. Азот может находится в виде NO, NO2, N2O и т.д. Но самый опасный NO и содержание его в выхлопных газах строго регламентируется. Повышенное содержание N в топливе ведет к сильному увеличению оксидов азота в выхлопных газах. Кислород и азот вместе называются балластом топлива. В жидких топливах содержание балласта 0.5- 1.5%, в твердых топливах гораздо больше.
Зола – смесь минеральных веществ, которая остается после сгорания горючей части топлива. Содержание золы обосновано дается на сухую массу.
Газообразное топливо – механическая смесь горючих и негорючих газов.
Горючая часть – СО, Н2, СН4, СnНm, H2S; Негорючая часть – N, CO2.
Теплосодержание веществ.
2Н2+О2=2Н2О+Q
Мера тепловой энергии, накапливаемой веществом при его образовании, называется теплосодержанием, или энтальпией.
Теплота образования вещества - DН со знаком (+), если теплота поглощается химическим соединением, и со знаком (-), если теплота выделяется при реакции, то есть «уходит» из системы.
Стандартная теплота образования 1 моля вещества при давлении 101,3 кПа и температуре 298 К - 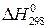 .
.
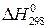 = - 393,5 кДж/моль у СО2
= - 393,5 кДж/моль у СО2
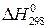 = - 241,8 кДж/моль у Н2Огаз
= - 241,8 кДж/моль у Н2Огаз
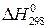 С2Н2 = +226,8 кДж/моль у ацетилена
С2Н2 = +226,8 кДж/моль у ацетилена
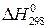 =+217,9 кДж/моль для Н2= Н++ Н+.
=+217,9 кДж/моль для Н2= Н++ Н+.
Для чистых веществ, состоящих из одного химического элемента в устойчивой форме (Н2, О2, С, Na и др.) DН условно принята равной нулю.
Теплота сгорания – это количество теплоты выделяющееся при полном сгорании топлива, измеряется в СИ, Дж, кал =Q. В ед. массы: Дж/кг; кал/кг.
Для органическихих топлив различают высшую и низшую теплоту сгорания.
Высшая – это низкая теплота сгорания + теплота конденсации.
Удельная теплота сгорания – важнейший показатель практической ценности топлива. Теплота сгорания определяется калориметрическим методом.
Низшая: -Q0; Высшая: +Qн;
Qн - Q0 = k(W + 9H), где
W – содержание воды в топливе по массе;
Н – количество Н в топливе по массе;
k – коэффициент = 25кДж/кг.
Для ~ расчетов теплота сгорания м/б определена по эмпирическим формулам на основании знания состава топ..
Формула Менделеева:
Qр=81Ср+300Нр-26(Ор-Sр)-6(9Hр +Wр), где Р- рабочая масса.
Ср, Нр ,Ор, Sр, Wр – содержание в рабочей массе топлива соответственно С, Н, О, S, W влаги в % по массе.
Qр=0,108Нр+0,126СОр+0,156СН4+0,5С2Н2+0,324H2S+и т.д.[мДж/м3]
Теплотворная способность зависит от состава. Чем выше горючих веществ, тем больше теплотворная способность.
Существует 2 способа:
1)эмпирический; 2)с помощью формул.
Условное топливо имеет теплотворную способность 29308кДж/кг=7000ккал/кг.
Для экзотермической реакции U2-U1=Q+ 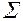 LI, где U2-U1- изменение внутренней энергии, Q –выделившееся тепло,
LI, где U2-U1- изменение внутренней энергии, Q –выделившееся тепло, 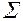 LI- совершенная работа.
LI- совершенная работа.
Для эндотермической реакции U2-U1= - Q+ 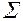 LI.
LI.
При V=const Qv=U1- U2+pDV, 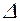 V=0 => Qv=
V=0 => Qv=  U.
U.
При p=const Qp=U1- U2 – pDV, Qp=I1-I2=DH.
U+pV=H – энтальпия. Следовательно теплота изобарной химической реакции равна изменению энтальпии системы. Qp=Qv-pV; pV=МRT; pΔV=ΔMRT; Qp=Qv-ΔМRT. Для реакций, протек. с увеличением числа молей, теплота Qv>Qp. Для реакций, протекающих с уменьшением числа молей, Qv<Qp. В реакциях, протекающих без изменения числа молей, Qv=Qp.
Qv=U1- U2; Qp=H1- H2=ΔH
Date: 2015-07-24; view: 716; Нарушение авторских прав