
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Распределение молекул по модулю скорости
|
|
Найдем вероятность того, что модуль скорости молекулы попадет в интервал 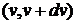 . Таким молекулам соответствуют все точки, попадающие в шаровой слой с радиусами
. Таким молекулам соответствуют все точки, попадающие в шаровой слой с радиусами 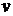 и
и 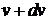 (рис. 1.4). Объем этого слоя равен произведению поверхности слоя на его толщину, т.е.
(рис. 1.4). Объем этого слоя равен произведению поверхности слоя на его толщину, т.е. 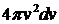 , объемная же плотность вероятности
, объемная же плотность вероятности 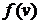 во всех точках слоя одинакова. Следовательно, согласно теореме сложения вероятностей, вероятность попадания в этот слой
во всех точках слоя одинакова. Следовательно, согласно теореме сложения вероятностей, вероятность попадания в этот слой
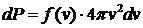 . (25)
. (25)
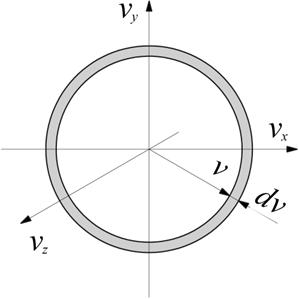
Рис. 1.4 Шаровой слой радиусов 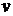 и
и 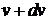
Величина 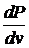 – мы ее обозначим
– мы ее обозначим 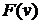 – характеризует искомую вероятность, т.е.
– характеризует искомую вероятность, т.е. 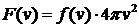 . Учитывая (23), получим:
. Учитывая (23), получим:
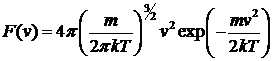 . (26)
. (26)
Эта формула представляет собой закон распределения Максвелла по модулю скорости. Вид функции 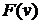 приведен на рис. 1.5. Эта функция тоже нормирована на единицу:
приведен на рис. 1.5. Эта функция тоже нормирована на единицу:
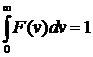 . (27)
. (27)
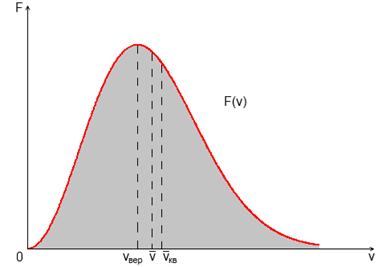
Рис. 1.5 Распределение скоростей молекул газа по модулю
Характерные скорости. К ним относятся три скорости: наиболее вероятная 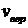 , средняя
, средняя 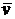 и среднеквадратичная
и среднеквадратичная 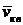 .
.
Наиболее вероятной скорости соответствует максимум функции распределения 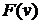 . Эта скорость определяется из условия
. Эта скорость определяется из условия 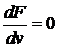 , откуда следует
, откуда следует
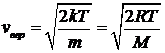 . (28)
. (28)
Средняя скорость по определению среднего значения случайной величины
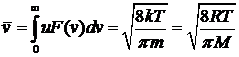 . (29)
. (29)
В качестве примера приведем среднюю скорость молекул азота N2 при 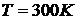 :
: 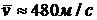 . Эта величина имеет порядок скорости звука в азоте,
. Эта величина имеет порядок скорости звука в азоте, 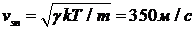 .
.
Среднеквадратичная скорость 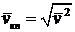 ; она находится из условия
; она находится из условия
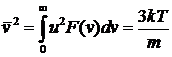 , (30)
, (30)
откуда
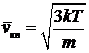 . (31)
. (31)
Этот результат можно получить и без интегрирования, а как следствие из выражения 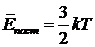 для средней поступательной кинетической энергии молекулы.
для средней поступательной кинетической энергии молекулы.
Приведенные характерные скорости отличаются друг от друга в пропорции (рис. 1.5)
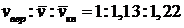 . (32)
. (32)
Зависимость распределения от 
Подставив значение 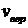 из (28) в формулу (26), получим, что
из (28) в формулу (26), получим, что
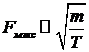 . (33)
. (33)
В соответствии с этим результатом для разных температур 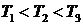 кривые распределения
кривые распределения 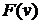 будут иметь вид, показанный на рис. 1.6. Видно, что с увеличением
будут иметь вид, показанный на рис. 1.6. Видно, что с увеличением 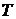 максимум функции смещается в сторону больших скоростей, а его величина уменьшается согласно (33). При этом площадь под всеми тремя кривыми остается равной единице. Кривые на рис. 1.6 можно рассматривать и иначе – как соответствующие разным массам молекул газа при одной и той же температуре, причем
максимум функции смещается в сторону больших скоростей, а его величина уменьшается согласно (33). При этом площадь под всеми тремя кривыми остается равной единице. Кривые на рис. 1.6 можно рассматривать и иначе – как соответствующие разным массам молекул газа при одной и той же температуре, причем 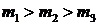 .
.
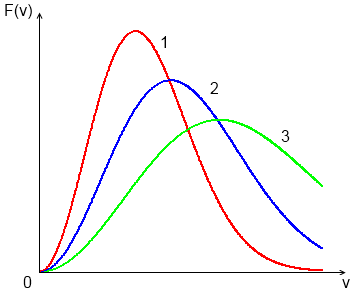
Рис. 1.6 Распределение молекул газа в зависимости от температуры.
Date: 2015-07-23; view: 794; Нарушение авторских прав