
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Распределение Максвелла
|
|
Закон распределения по скоростям молекул газа, находящегося в термодинамическом равновесии, был найден британским физиком Дж. К. Максвеллом в 1859г. Ход рассуждений Максвелла довольно сложен, поэтому полностью приводить его мы не будем, а ограничимся в основном рассмотрением подхода к решению этой проблемы.
Следует отметить, что задача о распределении молекул газа по скоростям, а также методы решения ее, приводимые дальше, являются чисто классическими. Поэтому необходимо выяснить границы применимости такого классического рассмотрения. Ответ можно получить, воспользовавшись принципом неопределенностей Гейзенберга. Выделим в газе маленький кубик со сторонами 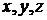 , на который в среднем приходится одна частица. Если выполнены условия
, на который в среднем приходится одна частица. Если выполнены условия
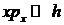 ,
, 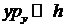 ,
, 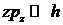 , (13)
, (13)
то движение частицы в этом кубике можно рассматривать классически. Величина
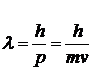 (14)
(14)
имеет размерность длины. Она называется длиной волны де Бройля и играет существенную роль в квантовой механике. Перемножив три неравенства и вводя 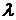 , мы получим условие применимости классического рассмотрения газа
, мы получим условие применимости классического рассмотрения газа
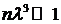 , (15)
, (15)
где 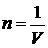 – концентрация частиц внутри кубика объемом
– концентрация частиц внутри кубика объемом 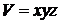 . Итак, среднее число частиц в объеме
. Итак, среднее число частиц в объеме 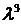 должно быть мало по сравнению с единицей.
должно быть мало по сравнению с единицей.
Для оценки порядка величины 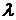 воспользуемся какой-либо средней скоростью, характеризующей тепловое движение молекул газа. При обращении к молекулярно-кинетической теории газов, в нашем распоряжении оказывается средняя квадратичная скорость
воспользуемся какой-либо средней скоростью, характеризующей тепловое движение молекул газа. При обращении к молекулярно-кинетической теории газов, в нашем распоряжении оказывается средняя квадратичная скорость 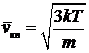 . Используя ее, придадим условию (15) вид
. Используя ее, придадим условию (15) вид
 , (16)
, (16)
где введено обозначение
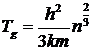 (17)
(17)
Величина 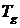 называется температурой вырождения газа. Для электронного газа в серебре (и других хорошо проводящих металлах)
называется температурой вырождения газа. Для электронного газа в серебре (и других хорошо проводящих металлах) 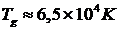 , что превышает температуру плавления серебра. Отсюда следует, что электронный газ в проводящих металлах всегда вырожден. Для гелия
, что превышает температуру плавления серебра. Отсюда следует, что электронный газ в проводящих металлах всегда вырожден. Для гелия 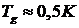 (у всех остальных газов еще меньшие значения
(у всех остальных газов еще меньшие значения 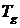 ). Имея столь низкие температуры вырождения, ни одно вещество не может находиться в газообразном состоянии при нормальных условиях. Именно поэтому все молекулярные газы далеки от вырождения и их можно рассматривать как классические системы.
). Имея столь низкие температуры вырождения, ни одно вещество не может находиться в газообразном состоянии при нормальных условиях. Именно поэтому все молекулярные газы далеки от вырождения и их можно рассматривать как классические системы.
Следуя Максвеллу, представим себе пространство скоростей с прямоугольными координатными осями, по которым будем откладывать значения проекций 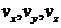 отдельных молекул. Тогда скорости каждой молекулы будет соответствовать точка в этом пространстве – конец вектора
отдельных молекул. Тогда скорости каждой молекулы будет соответствовать точка в этом пространстве – конец вектора  . Из-за столкновений молекул положения точек будут стремительно меняться, но их распределение в целом будет оставаться неизменным, поскольку макросистема находится в термодинамическом равновесии.
. Из-за столкновений молекул положения точек будут стремительно меняться, но их распределение в целом будет оставаться неизменным, поскольку макросистема находится в термодинамическом равновесии.
Вследствие равноправности всех направлений движения расположение точек относительно начала координат будет сферически симметричным. Поэтому плотность точек может зависеть только от модуля скорости v (но не от  ).
).
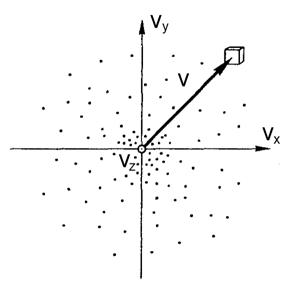
Рис. 1.2 Элементарный объем в пространстве скоростей
Итак, пусть газ содержит 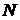 молекул. Выделим в некоторой точке – конце вектора
молекул. Выделим в некоторой точке – конце вектора 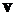 – малый объем
– малый объем 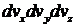 (рис. 1.2). Вероятность
(рис. 1.2). Вероятность 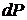 того, что скорость молекулы, т.е. конец вектора
того, что скорость молекулы, т.е. конец вектора 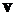 , попадет в этот объем, можно записать так:
, попадет в этот объем, можно записать так:
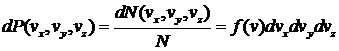 , (18)
, (18)
где 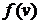 имеет смысл объемной плотности вероятности.
имеет смысл объемной плотности вероятности.
Вероятность же того, что молекула будет иметь проекции скорости в интервале 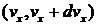 , есть
, есть
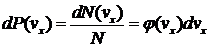 , (19)
, (19)
где 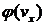 – функция распределения по
– функция распределения по 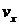 . Выражение (19) – это по существу интеграл (18) по
. Выражение (19) – это по существу интеграл (18) по 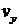 и
и  в тонком плоском слое от
в тонком плоском слое от 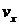 до
до  .
.
Считая вероятности того, что молекула имеет проекции скорости в интервалах 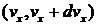 ,
,  и
и 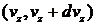 независимыми, в соответствии с теоремой об умножении вероятностей можно записать
независимыми, в соответствии с теоремой об умножении вероятностей можно записать
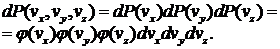 (20)
(20)
Это предположение мы примем пока без обоснований. По сравнению с другими доказательствами, данными самим Максвеллом, а затем Больцманом, первое доказательство Максвелла обладает тем преимуществом, что оно не вводит никаких специальных представлений относительно структуры молекул и сил взаимодействия между ними. Поэтому оно применимо не только к газам, но и к жидкостям и к твердым телам.
Сопоставив (20) и (18), находим
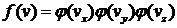 . (21)
. (21)
Опуская дальнейшие преобразования (с учетом условия нормировки), приведем окончательные результаты:
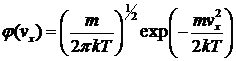 , (22)
, (22)
аналогичный вид имеют функции 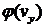 и
и 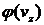 . Тогда, согласно (21)
. Тогда, согласно (21)
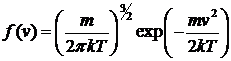 . (23)
. (23)
График функции 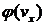 изображен на рис. 1.3. Он совпадает с гауссовой кривой погрешностей. Площадь заштрихованной полоски на рис. 1.3 – это вероятность того, что проекция скорости молекулы лежит в интервале
изображен на рис. 1.3. Он совпадает с гауссовой кривой погрешностей. Площадь заштрихованной полоски на рис. 1.3 – это вероятность того, что проекция скорости молекулы лежит в интервале 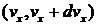 .
.
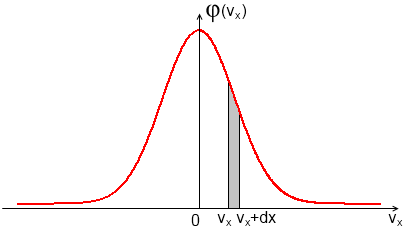
Рис. 1.3 Распределение скоростей молекул газа в проекции на ось 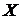
Функция (22) нормирована на единицу, т.е. площадь под кривой 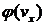
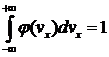 . (24)
. (24)
Интегрирование в пределах от 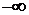 до
до 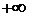 не означает, что в газе есть молекулы с такими большим скоростями. Это следует рассматривать только как вычислительный прием. Молекул с весьма большими скоростями очень мало, поэтому они не вносят никакого вклада в нормировочный интеграл. Это и позволяет записывать такие пределы.
не означает, что в газе есть молекулы с такими большим скоростями. Это следует рассматривать только как вычислительный прием. Молекул с весьма большими скоростями очень мало, поэтому они не вносят никакого вклада в нормировочный интеграл. Это и позволяет записывать такие пределы.
Date: 2015-07-23; view: 702; Нарушение авторских прав