
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Будова, iзомерiя, номенклатура i властивостi. Галогенопохiднi - продукти замiщення атомiв водню у вуглеводнях на атоми галогену (один або декiлька)
|
|
Галогенопохiднi - продукти замiщення атомiв водню у вуглеводнях на атоми галогену (один або декiлька).
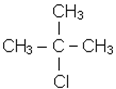
За кiлькiстю атомiв галогену в молекулi вони дiляться на моно-, ди-, три- i бiльше галогенопохiдних. Моногалогенопохiднi називають часто галогеналкiлами. За розташуванням атома галогену у вуглецевому ланцюзi вони подiляються на первиннi, вториннi i третиннi. Якщо атом галогену приєднується до вуглецю, що в свою чергу з’єднується тiльки з одним вуглецем, то галогенопохiдне називається первинним. Якщо галоген приєднується до вуглецю, зв’язаного з двома iншими атомами вуглецю, галогенопохiдне називають вторинним. Якщо галоген стоїть бiля третинного атома вуглецю, галогенопохiдне називають третинним. Наприклад:
| СН3 - СН2 - СН2Сl первинний хлористий | 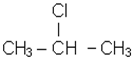
| 
|
| пропіл | вторинний | третинний |
Галогенопохiднi вуглеводнi називають за номенклатурами:
- тривiальною, або емпiричною, випадковою, яка не вказує на стуктуру сполуки (хлороформ СНСl3, фторотан CF3CHClBr);
- рацiональною, або радикально-функцiональною - називають вуглеводний радикал i галоген (хлористий етил C2H5Cl, хлористий вiнiл або вiнiлхлорид CH2=CHCl);
- мiжнародною - нумерують найдовший нерозгалужений ланцюг атомiв вуг-лецю, починаючи з боку ближчого до галогену, вказують цифрою його положення, називають галоген, потiм називають основний вуглеводень, наприклад:
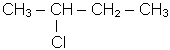
| 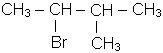
|
| 2-хлорбутан | 2-бром-3-метилбутан |
В IЧ-спектрi смуга поглинання при 800-600 см-1 характерна для хлорпохiдних, а при 600-500 см-1 для бром- i йодопохiдних. Галогенопохiднi через бiльшу електро-негативнiсть атомiв галогену є сполуками полярними i, отже, реакцiйноздатними. Галоген у них рухливий, легко замiщується на iншi атоми i групи атомiв. Проте, якщо галоген стоїть бiля вуглецю, зв’язаного подвiйним зв’язком, наприклад, СН2=СНСl, то внаслiдок спряження неподiленої електронної пари з близько розташованими p-електронами подвiйного зв’язку рухливiсть атомiв галогену зменшується. В сполуках типу хлористого алiлу CH2=CH-CH2Cl рухливiсть галогену збiльшена, тому що такi сполуки в процесi реакцiї дуже легко утворюють iон галогену i карбокатiон, заряд алiлкатiону стабiлiзується частковою компенсацiєю позитивного заряду сусiднiми електронами подвiйного зв’язку:
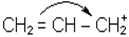 або
або 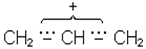
Реакцiї замiщення галогенiв у галогенопохiдних належать до реакцiй нуклео-фiльного замiщення:
1. SN2 - механiзм замiщення бiмолекулярний, одностадiйний. Характерний для первинних галогеналкiлiв. Вiдбувається з утворенням нестiйкого промiжного стану або активного комплексу:
R - X + Y ® Yd+ … R … Xd+ ® R - Y + X -;
2. SN1 - механiзм замiщення мономолекулярний, двохстадiйний. Характерний для третинних галогеналкiлiв i сполук алiльного типу, якi легко дисоцiюють на iони. Загальна схема:
a) RX  R+ + X -; б) R+ + Y -
R+ + X -; б) R+ + Y -  RY
RY
Перша стадiя бiльш повiльна, визначає швидкiсть реакцiї замiщення.
Галогенування ароматичних вуглеводнiв вiдбувається за механiзмом електро-фiльного замiщення SE2аром. В ролi каталiзаторiв застосовують кислоти Льюiса, найчастiше галогенiди залiза та алюмiнiю. Наприклад, хлорування бензолу може бути зображено такою схемою:
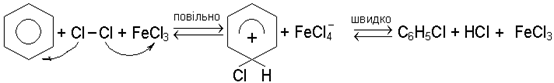
Галогенування гомологiв бензолу на свiтлi i при нагрiваннi супроводжується замiщенням водню в боковому ланцюзi (радикально-ланцюговий механiзм), у присут-ностi кислот Льюiса - в ядрi (механiзм SE2аром).
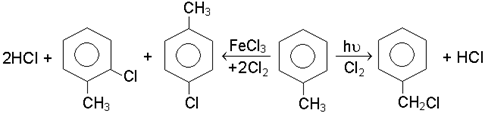
Фуран, пiрол, тiофен галогенуються легше бензолу, а пiридин - важче. В ре-зультатi прямого галогенування отримують сумiш продуктiв замiщення.
Date: 2015-07-02; view: 655; Нарушение авторских прав