
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Факторы, влияющие на формирование поствакцинального иммунитета
|
|
Формирование поствакцинального иммунитета, его напряженность и длительность зависят от различных факторов (рис. 1).
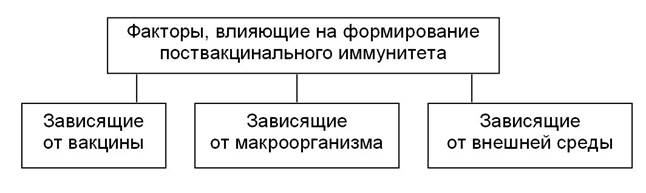
Рис. 1. Факторы, влияющие на формирование поствакцинального иммунитета
Факторы, зависящие от вакцины:
1. Соответствие вакцинного штамма циркулирующему возбудителю.
2. Наличие протективных антигенов. Основу каждой вакцины составляют протективные антигены, представляющие собой лишь небольшую часть микроорганизма и обеспечивающие развитие специфического иммунного ответа.
3. Иммуногенность. При естественной иммунизации или введении живых и инактивированных вакцин организм отвечает на все виды антигенов, входящих в состав микроорганизмов. При иммунизации химическими, субъединичными, рекомбинантными, синтетическими и ДНК-вакцинами иммунитет менее полноценен, так как он формируется под влиянием только отдельных антигенов. Однако с точки зрения выработки протективного иммунитета последние вакцины имеют преимущество.
Методы повышения иммуногенности вакцины:
· выделение, очистка, модификация протективного антигена;
· направленная доставка антигена;
· применение адъювантов и создание депо антигена.
4. Степень очистки вакцины во многом определяет ее качество
и снижение частоты побочных явлений при вакцинации. Для защиты от инфекции необходимо создание иммунитета к 1–2 главным антигенным детерминантам патогена. Однако современные технологии создания естественных вакцин не позволяют приблизиться к такой высочайшей степени очистки.
Хотя очистка вакцины от балластных веществ имеет принципиальное значение, примеси во многих вакцинах составляют до 90 %. Кроме основного действующего начала, вакцины содержат балластные вещества: компоненты разрушенных микробных клеток, адъювант, консервант, наполнитель, стабилизатор, компоненты питательных сред, на которых культивируются микроорганизмы. При этом в качестве консервантов, наполнителей и стабилизаторов используются вещества, допущенные для введения в организм человека. Консерванты входят в состав вакцин, производимых во всем мире. Они присутствуют в низких концентрациях и необходимы для обеспечения стерильности препаратов.
5. Доза вакцины должна быть оптимальной, обеспечивающей протективный эффект.
Следствия неправильного подбора дозы антигена:
1. высокая доза может индуцировать:
а) аутоиммунные реакции в результате поликлональной активации лимфоцитов, стимулирования образования аутоантител и специфических клонов аутореактивных лимфоцитов;
б) иммунологическую толерантность;
2. низкая доза способствует сенсибилизации организма, которая может проявиться впоследствии аллергической реакцией у предрасположенных лиц.
6. Длительность антигенного раздражения. Многие антигены
вызывают субоптимальный иммунный ответ. В то же время, чем дольше антигенное раздражение, тем напряженнее и длительнее иммунитет.
Для управления иммуногенностью вакцины применяют адъюванты (лат. ajuvare — помогать) — вещества или композиции веществ, которые при совместном введении с вакциной неспецифически усиливают иммунный ответ.
Классификация адъювантов по происхождению:
1. минеральные (коллоиды (Al(OH)3), кристаллоиды, растворимые соединения);
2. растительные (сапонины);
3. микробные структуры: корпускулярные (M. bovis, C. parvum и др.) и субъединичные: компоненты клеточной стенки (мурамилдипептид), ЛПС (пирогенал, продигиозан), рибосомальные фракции (рибомунил), нуклеиновые кислоты (нуклеинат натрия);
4. цитокины и пептиды тимусного (тактивин, тималин, тимоптин
и др.) и костномозгового (миелопид) происхождения;
5. синтетические (полиэлектролиты, полинуклеотиды и др.);
6. структуры типа целевой эпитоп – Тh-эпитоп – ТКР-эпитоп;
7. искусственные адъювантные системы (липосомы, микрочастицы).
Механизмы действия адъювантов:
1. Изменение свойств антигена (агрегатной структуры, молекулярной массы, полимерности, растворимости и др.).
2. Стимуляция АПК:
а) создание депо антигена, замедление его выделения из организма, повышение иммуногенности;
б) привлечение в место локализации антигена ИКК;
в) «адресная» доставка антигена АПК (макрофагам, дендритным клеткам).
3. Управление типом иммунного ответа:
а) программирование АПК на стимуляцию Th1/2/3/17;
б) мобилизация Тh памяти для ответа на вакцинный антиген;
в) создание микроокружения определенного типа.
4. Управление интенсивностью иммунного ответа:
а) стимуляция локальной воспалительной реакции;
б) усиление ранних этапов иммунного ответа (активации, пролиферации и дифференцировки ИКК).
Побочное действие адъювантов:
· изменения (морфологические и биохимические) в месте введения вакцины и регионарных лимфоузлах;
· повышение сенсибилизирующих свойств вакцины;
· неспецифическая поликлональная активация клеточных реакций.
7. Кратность введения говорит о том, сколько раз и с каким интервалом необходимо ввести вакцину для формирования иммунитета.
Первичная иммунизация (первое введение вакцины) называется праймингом. Бустерная иммунизация — это вторичная, третичная и т. д. иммунизация (например, 2-е и 3-е введение АКДС, ИПВ) с оптимальным интервалом 1 месяц.
Вакцинация может ограничиться праймингом (корь, эпидемический паротит, краснуха, туберкулез) либо состоять из прайминга и бустерных иммунизаций (полиомиелит, коклюш, дифтерия, столбняк, ВГВ). Бустерные иммунизации необходимы при введении слабоиммуногенных вакцин.
Интервалы между дозами при вакцинации строго регламентированы. Если через месяц ввести вакцину повторно, то титр антител быстро
увеличивается, они дольше сохраняются в организме. При уменьшении интервала между прививками вакцина нейтрализуется антителами, выработавшимися после ее первого введения. Увеличение интервала между прививками на качество иммунного ответа не влияет, но приводит к снижению иммунной прослойки. Такие дети могут заболеть раньше, чем им будет сделана повторная прививка. Если при введении вакцины очередная доза пропущена, вакцинацию следует провести при первой возможности, дополнительные дозы вакцины не вводят.
Вакцинация создает базовый иммунитет (так называемый грунд-иммунитет) и индуцирует развитие иммунологической памяти.
Ревакцинация — это гипериммунизация, т. е. повторное введение вакцины спустя определенный период времени после законченной вакцинации, на фоне истощения иммунитета от предшествующей вакцинации. Ревакцинация направлена на поддержание иммунитета, выработанного предыдущими вакцинациями. График проведения ревакцинации более свободный, обычно она проводится через несколько лет после вакцинации. После ревакцинации развивается вторичный иммунный ответ и уровень антител увеличивается. Механизм объясняется действием клеток памяти, образовавшихся в ходе первичного иммунного ответа на антиген. Однако максимальное повышение концентрации антител при ревакцинации возникает только при невысоких исходных титрах антител. Высокий предшествующий уровень антител препятствует дополнительной их выработке и длительному сохранению, а в некоторых случаях наблюдается снижение титров антител в результате нейтрализации.
Интервалы между прививками при введении разных вакцин. Было замечено, что при одновременном применении нескольких вакцин
иммунный ответ на них может меняться. Так, при одновременном применении вакцин против желтой лихорадки и против холеры или вакцин против желтой лихорадки и против кори иммунный ответ на одну или обе вакцины снижается. Кроме этого, их побочное действие может усиливаться, установить причину побочных реакций в данном случае обычно не удается.
ВОЗ считает возможным введение нескольких вакцин в один день только в тех случаях, когда их эффективность и безопасность точно установлены, что отражено в календаре прививок. При этом нельзя смешивать разные вакцины в одном шприце, так как это может привести к снижению их иммуногенности.
Если живые противовирусные вакцины не были введены в один день, то для предупреждения явления интерференции повторное введение возможно не ранее, чем через месяц. При уменьшении интервала эффективность иммунного ответа на введение второй живой противовирусной вакцины снижается, так как вакцинный штамм нейтрализуется белком интерфероном, синтез которого индуцируется введением первой противовирусной живой вакцины.
Факторы, зависящие от макроорганизма:
1. Состояние индивидуальной иммунореактивности определяется генотипом организма, в связи с чем в популяции всегда есть высоко
реагирующие индивидуумы (≈20 %), умеренно реагирующие (≈50–70 %), ареактивные (не отвечающие на антиген) (≈10 %). Наличие иммунодефицита препятствует или делает невозможным формирование поствакцинального иммунитета.
2. Возраст. Хуже поствакцинальный иммунитет формируется в периоды физиологических иммунодефицитов: у маленьких детей и пожилых людей.
Однако в иммунной системе доношенного новорожденного в ответ на введение антигенов развивается иммунный ответ, в том числе клеточный. Прививки следует проводить в раннем детском возрасте, когда уже существует риск возникновения инфекционных заболеваний, а пассивный материнский иммунитет постепенно утрачивается, и восприимчивость
к возбудителям инфекционных заболеваний возрастает. Дети охвачены системой меднаблюдения в наибольшей мере, что позволяет:
· обеспечить иммунную прослойку, делающую вакцинацию эффективной;
· осуществлять контроль за развитием побочных явлений при
вакцинации.
Снижение эффективности поствакцинального иммунитета в пожилом возрасте обусловлено возрастной инволюцией тимуса и развитием клеточного иммунодефицита.
3. Состояние организма в целом. Перед вакцинацией нужно ответить на вопрос: готов ли организм к прививке? При подготовке к прививке необходимо учесть все факторы и выбрать оптимальный момент в состоянии здоровья индивидуума.
4. Наличие противопоказаний. Перечень противопоказаний к проведению прививок определен в инструктивно-методических документах.
Факторы, зависящие от внешней среды:
1. Общественно-политические. Миграция населения ведет к трудностям охвата населения прививками и соблюдения календаря, в результате иммунная прослойка снижается.
2. Соблюдение правил хранения вакцины. Транспортировка и хранение вакцин должны осуществляться с соблюдением требований «холодовой цепи». Необходимо строго соблюдать сроки хранения вакцин после вскрытия ампул, забора вакцин из многодозовых флаконов.
3. Соблюдение техники вакцинации. Дозировка и методы введения вакцины определяются в соответствии с инструкцией по ее применению. Неассоциированные вакцины вводят отдельными одноразовыми шприцами в разные участки тела. Лучше избегать введения двух вакцин в одну конечность (особенно, если одним из вводимых препаратов является АКДС). В тех случаях, когда приходится делать инъекции в одну конечность, то лучше это делать в бедро (из-за большей мышечной массы). Инъекции должны отстоять друг от друга не менее чем на 3–5 см, чтобы не перекрылись возможные местные реакции.
4. Медицинская грамотность населения. Вакцинируемые (их родители) должны знать о важности иммунизации для предупреждения риска развития заболевания, иметь всю информацию о вакцинах, их эффектах и противопоказаниях к прививкам.
5. Правильная подготовка к вакцинации и соблюдение поствакцинального режима.
6.
Вакцины
7. Вакцинами, по предложению Л.Пастера, называют все прививочные препараты, получаемые из микроорганизмов, их антигенов и токсинов, которые применяются для активной иммунизации людей и животных с профилактическими и лечебными целями. Это название дано в честь Э.Дженнера, впервые получившего вакцину против натуральной оспы с использованием инфекционного материала от коровы (vaccina – коровья).
8. Вакцины, которые широко используются в настоящее время, получают из микроорганизмов, продуктов их жизнедеятельности или из их антигенов и подразделяют на живые (аттенуированные), инактивированные (убитые), анатоксины, рекомбинантные генно-инженерные и комбинированные вакцины. Интенсивно разрабатываются ДНК-вакцины, против многочисленных возбудителей вирусных, бактериальных и паразитарных заболеваний, получены экспериментальные антиидиотипические вакцины. Разрабатываются вакцины, содержащие продукты генов главного комплекса гистосовместимости (ГКГ), растительные и мукозальные вакцины.
9. Каждый тип вакцин имеет принципиальные особенности, преимущества и недостатки, связанные с методами и схемами их применения, механизмом развития поствакцинального иммунитета, его длительностью и прочностью, реактогенностью и т.д.
10. Живые (аттенуированные) вакцины — это взвеси выращенных на различных питательных субстратах в условиях производственных лабораторий вакцинных штаммов микроорганизмов (бактерии, вирусы, риккетсии). Основным свойством вакцинных штаммов, принципиально отличающим их от циркулирующих в природе патогенных штаммов – возбудителей инфекционных заболеваний, является генетически закрепленная утрата ими патогенных свойств и потеря способности вызывать в организме человека типичное инфекционное заболевание. Вместе с тем вакцинные штаммы обладают способностью «приживаться» в организме человека, т.е. размножаться как в месте введения, так и в дальнейшем в регионарных лимфатических узлах и внутренних органах.
11. Пребывание и размножение в организме вакцинного штамма длится обычно несколько недель и, не сопровождаясь клиническими проявлениями, характерными для данного заболевания, приводит к формированию иммунитета против инфекционного заболевания, вызываемого патогенными формами соответствующего возбудителя. В отдельных случаях (например, при применении вакцины БЦЖ) вакцинные штаммы в виде L-форм переживают в организме в течение нескольких лет.
12. Вакцинные, или аттенуированные, штаммы микроорганизмов получают следующими путями: пассированием через невосприимчивых животных; культивированием в неблагоприятных условиях жизнедеятельности для данного микроорганизма; отбором спонтанных мутантов от больных людей или животных; использованием методов генной инженерии. Одним из главных требований, предъявляемых к вакцинным штаммам, является стойкая, наследственно закрепленная утрата ими вирулентности.
13. Живые вакцины обладают преимуществами перед вакцинами других типов, наиболее существенными из которых являются: напряженность, прочность и длительность обусловливаемого ими иммунитета, приближающегося к постинфекционному, формирующемуся после инфекционного заболевания; однократность введения при вакцинации (определяется способностью вакцинных штаммов размножаться в организме человека и в течение длительного времени раздражать иммунную систему); возможность введения в организм человека не только парентерально, но и более простыми путями (накожно, перорально, интраназально).
14. Недостатком живых вакцин является возможность отмирания вакцинных штаммов в процессе производства, транспортировки и хранения. Чтобы избежать этого, при работе с живыми вакцинами необходимо учитывать следующее: более устойчивы живые вакцины, выпускаемые в виде сухих лиофилизированных препаратов; при транспортировке и хранении важно избегать нарушений в «холодовой цепи»; при вскрытии ампул и растворении их содержимого необходимо строго соблюдать правила асептики, так как живые вакцины не содержат консервантов; совершенно недопустим контакт с живыми вакцинами любых дезинфицирующих средств, инактивирующих микроорганизмы (особенно это важно при накожном введении живых вакцин; в этих случаях для дезинфекции кожи необходимо использовать легко испаряющиеся препараты – спирт, эфир); при применении живых бактерийных вакцин за 1-2 дня до прививки и в течение 1 недели (как минимум) после нее должно быть исключено применение антибиотиков, сульфаниламидов и иммуноглобулинов.
15. Наиболее широкое применение получили живые вакцины против кори, эпидемического паротита, туберкулеза, полиомиелита, туляремии, бруцеллеза, сибирской язвы, чумы и другие.
16.
17. Вакцины инактивировнанные (убитые) подразделяются на корпускулярные, химические, конъюгированные, расщепленные субвирионные и субъединичные вакцины.
18. Корпускулярные вакцины получены из цельных вирусов (цельновирионные)или бактерий (цельноклеточные), у которых прекращена биологическая способность к росту или репродукции. При изготовлении убитых вакцин полученные после выращивания взвеси бактерий или вирусов подвергают инактивации различными методами, основными требованиями к которым являются надежность инактивации и минимальное повреждающее действие на антигены бактерий и вирусов.
19. В зависимости от вида микроорганизма применяют тот или иной метод инактивации (нагревание, обработка ацетоном, спиртом, формалином, фенолом). Убитые вакцины более устойчивы при хранении, чем живые. Тем не менее, чтобы исключить возможность изменения их свойств, убитые вакцины необходимо хранить при температуре 6±2°С, не допуская замораживания жидких убитых вакцин, так как при последующем оттаивании возможны изменения физических свойств препарата: в нем могут появляться хлопья, происходить разрушение и лизис микробных клеток. Это приведет к повышению реактогенности вакцины за счет выхода бактерийных антигенов в жидкую фазу препарата.
20. Эффективность убитых вакцин ниже, чем живых. Основной способ их применения – подкожные инъекции, которые необходимо повторять из-за относительно короткого срока создаваемого убитыми вакцинами иммунитета. Для повышения иммуногенности используют сорбцию на адъювантах и бустерные иммунизации.
21. По иммуногенности корпускулярные вакцины уступают живым: через 10–14 дней индуцируют иммунный ответ продолжительностью до года. Слабая иммуногенность связана с денатурацией антигенов в процессе приготовления.
22. Корпускулярные вакцины хорошо ассоциируются, стабильны и безопасны. Они не вызывают заболеваний, так как реверсия и приобретение вирулентности невозможны. Корпускулярные вакцины высокореактогенны, вызывают сенсибилизацию организма и индуцируют аллергические реакции. Выпускаются в жидком и сухом виде. Они не так чувствительны к условиям хранения, как живые вакцины, но их нельзя использовать после замораживания.
23. В практике здравоохранения убитые вакцины применяют против коклюша, гриппа, клещевого энцефалита, брюшного тифа, паратифов, холеры.
24. Химические вакцины содержат наиболее активные по иммунологическим свойствам специфические компоненты – антигены, извлекаемые из микробных клеток химическими методами. Это сложные комплексы органических соединений – полисахаридов, полипептидов, липидов. выделенные из бактериальной биомассы вещества определённой химической структуры. Преимущество таких вакцин заключается в снижении количества балластных веществ и снижении реактогенности. Такие вакцины легче поддаются ассоциации. Кроме того, извлеченные из микробной клетки антигены более стабильны и их легче стандартизировать, чем корпускулярные вакцины. Недостаток химических вакцин, содержащих полисахаридные Т-независимые антигены, — независимость от рестрикции по антигенам ГКГС.
25. Среди препаратов этой группы используются вакцины против пневмококковой (Пневмо-23), менингококковой инфекций, брюшного тифа, дизентерии.
26. Конъюгированные вакцины — комбинации бактериальных полисахаридов с иммуногенным белком-носителем (обычно анатоксином другого типа микроорганизмов).Некоторые бактерии (гемофильная палочка, пневмококки) имеют антигены, которые плохо распознаются иммунной системой детей. В современных вакцинах полисахариды конъюгируют с иммуногенным белком-носителем, хорошо распознаваемым иммунной системой ребёнка. В результате иммуногенность конъюгированных вакцин повышается, а при их введении индукцируется Т-клеточная иммунологическая память.
27. Применяются вакцины против гемофильной инфекции (конъюгирована со столбнячным анатоксином), вакцина для профилактики пневмококковой инфекции (конъюгирована с дифтерийным анатоксином).
28. Расщепленные субвирионные (сплит) вакцины представляют собой препараты, в которых структурные компоненты вириона разъединены с помощью детергентов и очищены с помощью ультрафильтрации, гельфильтрации, хроматографии. Содержат поверхностные антигены и набор внутренних антигенов вирусов. Они имеют низкую реактогенность, высокую степень специфической безопасности и достаточную иммуногенную активность. Большинство сплит-вакцин разрешено использовать у детей с 6-месячного возраста. Применяются сплит-вакцины для профилактики гриппа.
29. Субъединичные (молекулярные) вакцины содержат протективные эпитопы (определенные молекулы) бактерий или вирусов. Преимущество субъединичных вакцин в том, что из микробных клеток выделяются иммунологически активные субстанции — изолированные антигены. При введении в организм растворимые антигены быстро рассасываются, поэтому для повышения напряженности иммунитета их сорбируют на адъювантах. Иммуногенность субъединичных вакцин выше, чем корпускулярных, но меньше, чем живых. Они малореактогенны, стабильны, легче подвергаются стандартизации, их можно вводить в виде ассоциированных препаратов.
30. Вариантом субъединичных вакцин являются вакцины с искусственным адъювантом, которые создаются при использовании естественных антигенов (гаптенная или слабоантигенная детерминанта) и синтетических носителей. Одним из вариантов является гриппозная вакцина, состоящая из белков вируса гриппа (гемагглютинина и нейраминидазы) и искусственной структуры (полиоксидония). Эта структура, кроме функции носителя и адъюванта, активно стимулирует более высокий иммунный ответ, особенно у тех индивидуумов или популяций, которые по своим природным особенностям не способны развивать выраженную иммунную реакцию на естественный антиген. Синтетические вакцины не содержат балластных веществ, поэтому считается, что они не должны вызывать побочные эффекты.
31. Субъединичные вакцины применяются для профилактики гриппа и коклюша (бесклеточная коклюшная вакцина).
32. Анатоксины – это иммунобиологические препараты, которые получают в результате соответствующей обработки экзотоксинов бактерий и применяют для выработки активного иммунитета у привитых. Возможность использования анатоксинов в целях профилактики связана с тем, что в основе патогенеза многих заболеваний (столбняк, дифтерия, ботулизм, газовая гангрена) лежит воздействие на организм специфических ядовитых продуктов, выделяемых возбудителями этих заболеваний – экзотоксинов.
33. Наряду со способностью вызывать патологические процессы в живом организме, экзотоксины обладают весьма важным свойством – антигенностью, т.е. способностью при введении в организм в небольших дозах вызывать образование специфических антител – антитоксинов. После добавления небольших количеств формалина и выдерживания в течение нескольких дней при температуре 37-40°С экзотоксины полностью теряют токсичность, сохраняя при этом свои антигенные свойства. Полученные таким образом из токсинов препараты были названы Рамоном анатоксинами. Анатоксины являются одними из наиболее эффективных и безопасных препаратов, используемых с целью активной иммунизации людей.
34. Анатоксины, предназначенные для иммунизации людей, готовят в виде очищенных, концентрированных препаратов, адсорбированных на геле гидроксида алюминия. Адсорбция анатоксинов на различных минеральных адсорбентах (в т.ч. на гидроксиде алюминия) обусловливает резкое повышение эффективности вакцинации. Это объясняется созданием в месте введения адсорбированного препарата депо антигена, а также замедленным его всасыванием: дробное поступление антигена из места инъекции обеспечивает эффект суммации антигенного раздражения, резко повышает иммунологический ответ. Помимо этого, депонирующее вещество вызывает в месте инъекции воспалительную реакцию. С одной стороны, это препятствует всасыванию антигена и усиливает депонирующее действие антигена, а с другой, являясь неспецифическим стимулятором, усиливает плазмоцитарные реакции в лимфатических тканях организма, участвующих в иммуногенезе.
35. Адсорбированные препараты перед употреблением необходимо взбалтывать, чтобы обеспечить во всем объеме равномерное распределение активного начала, которое перед взбалтыванием находится в осадке вместе с адсорбентом. В практике наиболее широкое применение получили дифтерийный, столбнячный и ботулинический анатоксины.
36. Рекомбинантные генно-инженерные вакцины получают методами генной инженерии с использованием рекомбинантной ДНК-технологии: гены вирулентного микроорганизма, отвечающие за синтез протективных антигенов, встраивают в геном носителя-вектора. Векторный микроорганизм продуцирует белки, кодируемые встроенным геном. Такая технология позволяет использовать для иммунизации очищенные протективные антигены. При этом исключается введение других микробных антигенов, которые не являются протективными, но могут индуцировать реакцию гиперчувствительности или обладать иммунодепрессивным действием.
37. Сегодня широко используются высокоиммуногенные рекомбинантные вакцины для профилактики ВГВ, полученные на основе клеток дрожжей-сахаромицетов, в геном которых встроен ген, кодирующий синтез HBs-Аg. В результате экспрессии вирусного гена дрожжи продуцируют HBs-Аg, который затем очищается и связывается с адъювантом. Рекомбинантные вакцины безопасны, достаточно иммуногенны, могут быть использованы для создания комплексных вакцин. Примером рекомбинантной вакцины является вакцина против гепатита В.
| Комбинированные вакцины содержат несколько антигенов. Установлено, что при правильном подборе антигенов и их доз целесообразно одновременно использовать не более 5-6 антигенов. При разработке комбинированных вакцин учитывается совместимость не только антигенных компонентов, но и адъювантов, консервантов, стабилизаторов. Достоинства заключаются в том, что при введении живых комплексных вакцин наблюдается феномен интерференции, уменьшается инъекционная нагрузка на ребенка, подлежащего прививкам по календарю. Примерами являются адсорбированная коклюшно-дифтерийно-столбнячная вакцина (АКДС), живая лиофилизированная вакцина против кори, паротита и краснухи (КПК). · Иммунные сыворотки и иммуноглобулины Вакцины могут вводиться в организм человека следующими способами: накожным, внутрикожным, подкожным, внутримышечным, интраназальным, пер-оральным. Выбор метода иммунизации зависит от иммуногенности вакцины и степени ее реактогенности. При вакцинации может быть использован безыгольный инъектор — аппарат для в/к или п/к введения вакцин, путем подачи их под давлением тонкой струей, способной пронизывать кожу. Накожновводятся сильнореактогенные живые вакцины. Местом введения могут быть наружная поверхность плеча на границе верхней и средней трети (чумная, туляремийная, сибиреязвенная, бруцеллезная); середина внутренней поверхности предплечья (чумная). Внутрикожновводятся сильнореактогенные живые бактериальные вакцины. Местом введения могут быть наружная поверхность плеча на границе верхней и средней трети (БЦЖ, чумная). Подкожновводятся живые (коревая, паротитная, краснушная, против желтой лихорадки и др.) и все инактивированные вакцины. В подкожной клетчатке мало нервных волокон и кровеносных сосудов; антигены депонируются в месте введения и медленно резорбируются. Местом введения могут быть подлопаточная область; наружная поверхность плеча на границе верхней и средней трети; передненаружная поверхность средней трети бедра. Внутримышечно— предпочтительный путь для введения сорбированных вакцин (АДС, против ВГВ и др.). Хорошее кровоснабжение мышц гарантирует максимальную скорость выработки иммунитета и максимальную его интенсивность, поскольку большее число иммунных клеток имеет возможность «познакомиться» с вакцинными антигенами. Местом введения детям до 18 мес. могут быть передненаружная поверхность верхней части бедра, детям старше 18 мес. и взрослым — дельтовидная мышца. Вводить вакцины в верхненаружный квадрант ягодицы крайне не рекомендуется.Во-первых, у новорожденных и детей раннего возраста ягодичная область бедна мышечной тканью и состоит преимущественно из жировой. При попадании вакцины в жировые ткани возможно снижение иммуногенности вакцины. Во-вторых, любая инъекция в ягодичную область сопровождается риском повреждения седалищного и других нервов. Интраназальнопутем распыления в носовые ходы (реже — из шприца без иголки) вводится живая гриппозная вакцина. Пероральновводится живая полиомиелитная вакцина (ОПВ). |
Date: 2015-07-01; view: 6932; Нарушение авторских прав