
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Попутний(супутний) нафтовий газ;
|
|
Нафта;
4. кам’яне вугілля.
Інші природні джерела вуглеводнів: сланцевий газ, буре вугілля, торф.
1. Природний газ складається в основному з метану СН4 (80-96%) в залежності від родовища.
Застосовується:
1. як газоподібне паливо у промисловості (в заводських котельнях,доменних печах, скловарних і цементних печах) і побуті;
2. як хімічна сировина для одержання різних орг.сполук.
2. Попутний нафтовий газ складається приблизно із однакової кількості метану – гексану (СН4 – С6Н14) в залежності від родовища.
Застосовується:
1. як газоподібне паливо;
2. розділюють його на окремі фракції:
- метан-етанова фракція («сухий газ»)
використовується як газоподібне паливо і як хім..сировина.
- пропан-бутанова фракція («зріджений газ»)
використовується як газоподібне паливо у тих місцевостях, де немає природного газу(балонний газ) та пальне в автомобілях.
- пентан-гексанова фракція («газовий бензин»)
використовується як добавки до бензину.
3. Нафта.
Нафта – це темна рідина, яка не розчиняється у воді і утворює тонку плівку на її поверхні. До складу нафти входять більше кілька сотень різних речовин - переважно вуглеводні, які містятьвід 1 до 40 атомів Карбону:
Алкани;
Циклоалкани;
Арени.
Нафта використовується тільки як хімічна сировина і піддається переробці. Використовують такі методи переробки нафти:
1. фізичні;
2. хімічні.
До фізичних метадів переробки нафти відноситься:
1. пряма або ректифікаційна перегонка нафти.
При цьому нафту нагрівають до 450-5000С вона переходить у газовий стан і направляють її у ректифікаційну колону у якій за різними температурами кипіння і за різним складом вуглеводнів з нафти одержують такі фракції:
1. бензин (пальне для автомобілів) – вуглеводні бензину містять 5-11 атомів С;
2. лігроїн (пальне для тракторів – ДП, розчинник лаків та фарб)); С8-С14
3. гас (пальне для літаків, побутові потреби – гасові лампи); С12-С18
4. газойль (ДП); С15-С20
5. мазут (паливо для котелень, а також мазут як нафту нагрівають до високої температури(тільки у вакуумі) і одержують різні фракції мастил і смолу(гудрон).
При прямій перегонці нафти одержують тільки 20% бензину і він є не високої якості. Для того, щоб одержати велику кількість бензину використовують хімічні методи переробки нафти:
1. крекінг;
2. риформінг.
Крекінг
Крекінг поділяється на:
1. термічний крекінг;
2. каталітичний крекінг.
При термічному крекінгу газойль нагрівають до високої температури і одержуємо бензин, що містить менші алкани і алкени(реакція крекінгу алканів)
С16Н34 → С8Н18 + С8Н16
октан октен
Бензин термічного крекінгу є кращий за бензин прямої перегонки.
При каталітичному крекінгу газойль нагрівають до високої температури і використовують каталізатор (сполуки алюмінію – біла глина) і відбувається крім реакції крекінгу ще реакція ізомеризації, утворених алканів:
А)С16Н34 → С8Н18 + С8Н16 СН3 СН3
октан октен | |
Б) СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН3→ СН3-С - С -СН3
октан | |
СН3 СН3
ізооктан
Бензин каталітичного крекінгу ще кращий за бензин термічного крекінгу.
Риформінг(облагородження, ароматизація бензинів)
При цьому процесі використовують бензин прямої перегонки нафти і піддають реакції дегідрування з одночасною циклізацією (дегідроциклізація) вуглеводнів-алканів бензину і утворюються циклоалкани і арени:
С6Н14 → С6Н12 + Н2 → С6Н6 + 3Н2
гексан циклогексан бензен
Бензин риформінгу є найкращим із всіх бензинів.
Якість бензинів(детонаційна стійкість бензинів) визначається октановим числом. Октанове число має шкалу від 0 до 100. Октанове число 0 має н.-гептан, а 100 – ізооктан. Чим вище значення октанового числа,тим кращий бензин.
4. Кам’яне вугілля.
Кам’яне вугілля використовується:
1. як тверде паливо, однак наявність негорючих домішок при окисненні перетворюється на шлаки, а також наявність сполук сульфуру природить до забруднення атмосфери(кислотні дощі);
2. як хімічна сировина (процес коксування).
В процесі коксування кам’яне вугілля нагрівають його до 10000С протягом 14 годин і одержують такі продукти:
1. кокс (для виробництва чавуну і сталі, а також як паливо у кузнях);
2. коксовий газ (як газоподібне паливо);
3. кам’яновугільна смола ( джерело різних аренів: бензен. толуен,
фенол, нафталін і т.д.);
4. аміачна вода (як азотне добриво).
Оксигеновмісні органічні сполуки
Спирти і феноли містять функціональну (характеристичну) групу – гідроксильну або гідрокси-групу - ─ОН.
Тема 26. Спирти і фенол.
Спирти
Спирти – це похідні від вуглеводнів, в яких один або всі атоми Н почергово заміщені на групу ОН.
Група ОН для спиртів є функціональною(характеристичною) групою –
це група атомів, яка визначає будову, фізичні та хімічні властивості даного класу речовин.
Група ОН називається гідроксильною групоюабо гідрокси- групою.
Загальна формула спиртів: R(OH)n.
Спирти класифікують за:
І. вуглеводневим радикалом:
- насичені;
- ненасичені
- ароматичні.
ІІ. числом груп ОН:
- одноатомні;
- багатоатомні(двоатомні,триатомні і т.д.).
Найбільше практичне значення мають насичені! одноатомні і багатоатомні спирти.
Насичені одноатомні спирти (Алканоли).
Загальна формула спиртів: СnH2n+1ОН де: n = 1,2,3,4 і т.д. або
ROH, де R – СН3, С2Н5, С3Н7 і т.д.
або CnH2n+2 O де: n = 1,2,3,4 і т.д.
Номенклатура алканолів
За міжнародною(систематичною або номенклатурою ІЮПАК) назви спиртів походять від відповідних назвалканів із додаванням закінчення ол.
За історичною номенклатурою назви спиртів походять від відповідних назв радикалів алканів з додаванням закінчення овий і слово спирт.
СН3 ОН - метанол, метиловий спирт
С2Н5 ОН - етанол, етиловий спирт
С3Н7 ОН - пропанол, пропіловий спирт
1 2 3 3 2 1
СН3- СН─СН3 СН3- СН2─СН2- ОН
|
ОН пропан-1-ол
пропан-2-ол
Алгоритм
для складання назв розгалужених одноатомних спиртів за структурними формулами:
- Визначити (виокремити) найдовший карбоновий ланцюг – родоначальну структуру (головний ланцюг), що містить характеристичну (функціональну) групу – ОН.
- Пронумерувати атоми Карбону родоначальної структури. При цьому нумерацію необхідно починати з того кінця до якого ближче характеристична група – ОН.
- У назві вуглеводню спочатку
наводяться назви замісників, приєднаних до родоначальної структури,
із вказівкою номера атома Карбону, до якого вони приєднані. Номери
атомів Карбону(локанти) відокремлюються від назв замісників дефісом.
- Якщо замісників декілька, то в назві вони наводяться в українському алфавітному порядку (за першими буквами їх назв). Якщо є декілька однакових замісників, то їхня назва вказується тільки один раз, а їхнє число вказується префіксами: ди(два), три(три), тетра(чотири), пента(п´ять) тощо й обов´язково цифрами(локантами) через кому вказується положення кожного з однакових замісників.
- Після цього записується назва у відповідності до назви алкану, що містить таке ж число атомів Карбону в родоначальній структурі.
- Потім вказують цифрою(локантом) атом Карбону родоначальної структури, біля якого розміщена характеристична група - ОН, відокремлюючи двома дефісами(справа і зліва).
- В останню чергу записуємо закінчення – ол.
СН3
1 2 3 4| 5
СН3- СН─СН2 ─С ─СН3
||
ОН СН3
4,4-диметилпентан-2-ол
Цифри, які стоять у назвах спиртів перед замісниками і перед розміщенням групи ОН називаються локантами.
Тільки! одноатомні спирти поділяються на:
1. первинні[ п.] (група ОН знаходиться біля атома Карбону, що зв’язаний тільки з одним атомом Карбону);
СН3
1 2 3 4| 5
СН2 ─ СН2 ─СН2 ─СН─СН3
│
ОН
4-метилпентан-1-ол
2. вторинні[ в.] (група ОН знаходиться біля атома Карбону, що
зв’язаний тільки з двома атомами Карбону);
СН3
1 2 3 4| 5
СН3 ─ СН ─ СН2 ─С─СН3
||
ОН СН3
4,4-диметилпентан-2-ол
3. третинні [ т.] (група ОН знаходиться біля атома Карбону, що зв’язаний тільки з трьома атомами Карбону).
СН3
5 4 3 2| 1
СН3─СН2 ─ СН2 ─ С ─ СН3
|
ОН
2-метилпентан-2-ол
Фізичні властивості спиртів
Перші представники спиртів – це рідини, добре розчинні у воді, мають специфічний запах (СН3 ОН – отруйний, С2Н5 ОН – наркотик). Вищі спирти – тверді речовини, не розчинні у воді.
Спирти є рідинами тому(на відміну від алканів з яких вони походять), що між молекулами існує водневий зв’язок. Спирти з а свєю будовою і фіз.. властивостями більше подібні до води і між молекулами води також існує водневий зв’язок (Н-ОН і R-ОН. Алканоли є і похідними від води, в якій один атом Н заміщений на вуглеводневий радикал).
δ+Н ─ Оδ- ·· ·· δ+Н ─ Оδ- ·· ·· δ+Н ─ Оδ- ·· ·· δ+Н ─ Оδ- вода
| | | |
Н Н Н Н
δ+Н ─ Оδ- ·· ·· δ+Н ─ Оδ- ·· ·· δ+Н ─ Оδ- ·· ·· δ+Н ─ Оδ- спирти
| | | |
R R R R
Хімічні властивості спиртів
Всі хімічні властивості спиртів відбуваються по групі ОН як характеристичній (функціональній) групі спиртів.
І. Реакції по атомі Н групиОН
1. реакція з лужними і лужно-земельними металами
2СН3 ОН + 2Na → 2СН3 ОNa + H2↑
Натрій метилат
2C3Н7 ОН + Ca → (С3Н7 О)2Ca + H2↑
Кальцій пропілат
[Подібно як вода: 2Н ОН + 2Na → 2NaОН + H2↑ ]
Сполуки формулою R-ONa називаються алкоголяти ( це солі – йонні сполуки).
ІІ. Реакції по групі ОН
1. реакція з галогеноводнями (HCl, HBr, HI)
При цьому група ОН спиртів заміщується на галоген.
СН3 ОН + HBr → СН3–Br + Н2О
бромметан
2. реакція дегідратації ( починаючи від C2Н5 ОН )
А) внутрішньомолекулярна дегідратація
Від однієї молекули спирту відщеплюється молекула води (група ОН і атом Н від атома С, що є сусіднім з атомом С, біля якого безпосередньо знаходиться група ОН) і утворюється а лкен. Каталізатор конц. H2SO4 і температура > 1400С
С2Н5 ОН → С2Н4 ↑ + Н2О
С3Н7 ОН → С3Н6 ↑ + Н2О
Б) міжмолекулярна дегідратація
Від двох молекул спирту(однакових або різних) відщеплюється молекула води (атом Н від групи ОН першої молекули спирту і група ОН від другої молекули спирту) і утворюється етери (формулою R-O-R). Каталізатор конц. H2SO4 і температура < 1400С
2С2Н5 ОН → С2Н5-О-С2Н5 + Н2О
Діетиловий етер
С2Н5 ОН + С3Н7 ОН → С2Н5-О-С3Н7 + Н2О
Етилпропіловий етер
3. реакція дегідрування
Від однієї молекули спирту відривається молекула водню Н2 ( один атом Н від групи ОН, а другий Н від атома С біля якого безпосередньо знаходиться група ОН) і утворюється альдегід.
О
СН3 ОН → Н-С + Н2
Н
Метаналь (альдегід)
О
СН3-СН2 ОН → СН3 - С + Н2
Н
Етаналь, оцтовий альдегід
IІ. реакція окиснення
1. реакція горіння (повне і неповне):
Внаслідок реакції повного горіння вуглеводнів утворюється завжди СО2 і Н2О.
2С3Н7 ОН + 9О2 → 6CО2 + 8H2О
С2Н5 ОН + 3О2 → 2CО2 + 3H2О
2. реакція окиснення розчином KMnO4
Спирти окислюються розчином KMnO4, знебарвлюючи його, і при цьому утворюються альдегіди ( відбувається окиснення С-Н зв´язку біля атома С який безпосередньо зв´язаний з групою ОН )
О
СН3 ОН + [О] → Н- С + Н2О
Н
О
СН3-СН2 ОН + [О] → СН3 - С + Н2
Н
Етаналь, оцтовий альдегід
Добування спиртів
І. СН3 ОН
У промисловості одержують:
- із «водяного газу» (СО +Н2):
СО + 2Н2 → СН3 ОН
- при розкладі деревини.
ІІ. С2Н5 ОН
1. У промисловості одержують:
- реакцією спиртового бродіння глюкози:
С6Н12О6 → 2 С2Н5 ОН + 2СО2↑
-реакцією гідратації етилену в присутності конц. фосфатної кислоти:
C2H4 + H2О → C2H5 -OH
ІІІ. Загальні методи добування
-реакцією гідратації алкенів в присутності конц. фосфатної кислоти:
C3H6 + H2О → C3H7 -OH
- Реакція лужного гідролізу моногалогеналканів в присутності водного! розчину лугу
Водн.р-н лугу
C2H5Cl + NaOH → C2H5 ОН + NaCl
Застосування спиртів
І. СН3 ОН (деревний спирт)
1. як розчинник для лаків і фарб;
2. як замінник бензину;
ІІ. С2Н5 ОН (винний спирт)
1. як розчинник у парфумерії;
2. в харчовій промисловості як консервант;
3. як алкогольний напій;
4. для одержання синтетичного каучуку (бутадієновий каучук);
5. як замінник бензину(пальне для автомобілів).
Багатоатомні спирти
Найбільш практичне значення мають дво і триатомні спирти. Необхідно пам’ятати, що кожна група ОН повинна знаходитися біля одного атома Карбону. За міжнародною номенклатурою назви їх походять від назв алканів з додаванням закінчення -діол чи тріол. Для деяких з них характерні і історичні назви.
СН2 – СН2 СН2 – СН -СН2
| | | | |
ОН ОН ОН ОН ОН
Етан-1,2-діол пропан-1,2,3-тріол
етиленгліколь гліцерин, гліцерол
За фізичними властивостями багатоатомні спирти – це олієподібні рідини, добре розчинні у воді, солодкі на смак ( органічні сполуки, які містять 2 і більше груп ОН є солодкими на смак). Етиленгліколь – отруйний, а гліцерин – не шкідливий для людського організму( має гігроскопічні властивості використовується для пом´якшення шкіри в шкіряній промисловості та фармації).
Хімічні властивості багатоатомних спиртів
В багатоатомних спиртах на відміну від одноатомних спиртів групи ОН впливають одна на одну і атоми Н стають більш рухливим у порівнянні з одноатомними (багатоатомні спирти – слабкі кислоти). У хімічних реакціях може брати участь як одна група ОН так і всі почергово.
І. Реакції по атомі Н групиОН
1. реакція з лужними і лужно-земельними металами
СН2 ОН CН2 ОNa
| + 2Na → | + Н2
СН2 ОН СН2 ОNa
Натрій гліколят
СН2 ОН CН2 ОNa
| |
2СН ОН + 6Na → 2СН ОNa + 3Н2↑
| |
СН2 ОН СН2 ОNa
Натрій гліцерат
2. реакція з нітратною кислотою
Атоми Н груп ОН заміщуються на нітро-групу (вплив груп груп ОН одна на одну)
СН2 ОН CН2 О-NО2
| |
СН ОН + 3НО-NО2 → СН О-NО2 + 3Н2О
| |
СН2 ОН СН2 О-NО2
тринітрогліцерин
3. реакція з Сu(OH)2
Якісна реакція на багатоатомні спирти - це взаємодія багатоатомних спиртів з голубим осадом Сu(OH)2 при звичайних умовах при цьому утворюється синій прозорий розчин (вплив груп ОН одна на одну)
СН2 ОН CН2 О
| | Cu
СН ОН + Cu(OH)2 → СН- О + 2Н2О
| голубий |
СН2 ОН осад СН2 ОH
Купрум (ІІ) гліцерат (синій прозорий розчин)
ІІ. Реакції по групах ОН
1. реакція з галогеноводнями (HCl, HBr, HI)
СН2 ОН CН2 Cl
| |
СН ОН + 3НCl → СН- Cl + 3Н2О
| |
СН2 ОН СН2 Cl
IІІ. реакція окиснення
1. реакція горіння:
Внаслідок реакції повного горіння спиртів утворюється завжди СО2 і Н2О.
2С3Н8О3 + 7О2 → 6CО2 + 8H2О
Добування спиртів
І. Гліцерин
1. У промисловості одержують гідролізом жирів.
2. Реакція лужного гідролізу 1,2,3-трихлоропропану в присутності водного! розчину лугу
CН2 Cl CH2 ОН
| |
СН- Cl + 3KОH → CH-ОН + 3KCl
| |
СН2 Сl СН2 ОН
Застосування cпиртів
І. Гліцерин
1. як незамерзаюча рідина в радіаторах машин (ТОСОЛ) -антифриз;
2. для одержання вибухівки;
3. у косметичній і шкіряній промисловості(гігроскопічність);
4. 1%-ний розчин три нітрогліцерину використовують в медицині як
препарат, що розширює кровоносні судини.
Фенол
Фенол – це похідне від бензену, в якому один атом Н заміщений безпосередньо на групу ОН.
С6Н5 ОН – фенол або гідроксибензен.

Необхідно пам’ятати: у фенолі група ОН безпосередньо зв’язана з бензеновим ядром, а в вроматичних спиртах група ОН зв’язана хоча б через один атом Карбону: С6Н5 ОН – фенол; С6Н5 – СН2 - ОН – бензиловий спирт (ароматичний спирт).

За фізичними властивостями фенол – це кристалічна речовина, трохи розчинна у воді, дуже отруйна.
Хімічні властивості фенолу
У м олекулі фенолу відбувається взаємний вплив груп атомів одна на одну (С6Н5 і ОН) (подібно як в толуені).
С6Н5 так впливає на групу ОН, що атом Н її стає ще більш рухливим (С6Н5 має властивість відтягувати спільну пару електронів від атома Оксисену групи ОН, таким чином атом О стає позитивним, а він в свою чергу відтягує спільну пару електронів від атома Н, бо атом О є після Флюору найбільш електронегативним), ніж в багатоатомних спиртах (фенол є слабкою кислотою – карболова кислота).
Група ОН таквпливає на бензенове ядро (С6Н5)( група ОН має властивість відштовхувати спільну пару електронів до атома С бензинового ядра, таким чином порушує спряження в ньому і неоднаково поляризується С-Н зв′язок в різних положеннях бензенового ядра), що атоми в положеннях 2,4,6- стають більш рухливішими і можуть заміщуватися на атоми або групи атомів.
І. Реакції по атомі Н групиОН
1. реакція з лужними і лужно-земельними металами ( легше, ніж з спиртами)
2С6Н5 ОН + 2Na → 2С6Н5 ОNa + H2↑
Натрій фенолят
2. реакція з лугами (тільки для фенолу)
С6Н5 ОН + NaОН → С6Н5 ОNa + H2О
3. реакція з FeCl3 – це якісна реакція на фенол, при цьому утворюється фіолетовий осад
3С6Н5 ОН + FeCl3 → (С6Н5 О)3Fe ↓ + 3 HCl
Ферум(ІІІ) фенолят (фіолетовий осад)
ІІ. Реакція по групі ОН
1. реакція з галогеноводнями (HCl, HBr, HI)
Реакція з галогеноводнями не характерна для фенолу тому, що С6Н5 – феніл-радикал міцно утримує групу ОН і не дає можливості замістити її на галоген.
ІІІ. Реакції заміщення( по групі С6Н5)
1. реакція галогенування (з «хлорною» чи «бромною водою») При цьому утворюється білий осад.(якісна реакція на фенол ).
С6Н5-ОН + 3Cl2 → С6Н2(Cl3) -ОН ↓ + 3HCl
2,4,6-трихлорофенол
2. реакція нітрування
k. H2SO4
С6Н5-ОН + 3HO-NO2 → C6H2(NO2)3ОН + 3H2O
2,4,6-тринітрофенол (пікринова кислота)

IV. реакція окиснення
1. реакція горіння:
Внаслідок реакції повного горіння фенолу утворюється СО2 і Н2О.
С6Н5ОН + 7О2 → 6CО2 + 3H2О
Добування фенолу
І. С6Н5 ОН
У промисловості одержують за схемою:
С6Н6 → С6Н5 Cl → С6Н5 ОН
1. С6Н5 ОН + Cl2 → С6Н5 Cl + HCl
2. С6Н5 Cl + NaOH → С6Н5 ОН + NaCl
Застосування фенолу
І. С6Н5 ОН (карболка, карболова кислота)
1. як антисептик (для дезинфекції громадських приміщень);
2. для виробництва ліків, пластмас (фенол формальдегідних смол), вибухових речовин(пікринова кислота – жовтий барвник), лужного індикатора (фенолфталеїн).
Тема 27. Альдегіди, карбонові кислоти, естери.
Альдегіди, карбонові кислоти, естери (жири) всі містять функціональну (характеристичну) групу – карбонільну - ─С=О
│
Альдегіди
Альдегіди – це органічні сполуки, що містять функціональну (характеристичну) – альдегідну групу, зв’язану з вуглеводневим радикалом(може бути і атом Н).
Група –СНО або - С(О)Н або - альдегідна група

Загальна формула альдегідів: СnH2n+1 С(О)Н де: n = 0,1,2,3,4 і т.д. або
R-СHО або R-С(O)H, де R – Н, СН3, С2Н5, С3Н7 і т.д.
aбо CnH2nO де: n = 1,2,3,4 і т.д.
Номенклатура альдегідів
За міжнародною(систематичною або номенклатурою ІЮПАК) назви альдегідів походять від відповідних назв алканів, включаючи атом Карбону альдегідної групи, із додаванням закінчення аль. (Особливість альдегідної групи у порівняння з гідрокси-групою)
За історичною номенклатурою назви альдегідів походять від відповідних назв карбонових кислот
НС(О)Н - метаналь, мурашиний альдегід, формальдегід
СН3 С(О)Н - етаналь, оцтовий альдегід, ацетальдегід
С2Н5 С(О)Н - пропаналь, пропіоновий альдегід
С3Н7 С(О)Н - бутаналь, масляний альдегід
С4Н9 С(О)Н - пентаналь, валеріановий альдегід
С5Н11 С(О)Н - гексаналь, капроновий альдегід
СН3
5 4 3 2| 1О
СН3─СН─СН2─С ─С
||Н
СН3 СН3
2,2,4-триметилпентаналь
Цифри, які стоять у назвах альдегідів перед замісниками називаються локантами.
Фізичні властивості альдегідів
Перший представник альдегідів (формальдегід) є газом тому, що на відміну від спиртів між молекулами не існує водневого зв’язку. Всі інші альдегіди є рідинами, добре розчинні у воді, мають різкий запах.
Хімічні властивості альдегідів
Всі хімічні властивості альдегідів відбуваються по характеристичній (функціональній) групі - -С(О)Н.
І. Реакції приєднання по С=О (подібно як алкени С=С)
1. реакція гідрування
СН3 С(О)Н + Н2 → СН3 СН2ОН
3. реакція гідрогалогенування
СН3 С(О)Н + НCl → СН3 СНOH 1-хлороетан-1-ол
|
Cl
ІІ. Реакції по атомі Н альдегідної групи
1. реакція «срібного дзеркала»
Це взаємодія альдегідів з Ag2O (аміачний розчин) – реактив Толленса і при цьому окислюється С-Н зв’язок і утворюється карбонова кислота і срібло – це якісна реакція на альдегіди
НС(О)Н + Ag2O → HCOOH + 2Ag↓ сріблястий наліт

2. реакція «мідного дзеркала»
Це взаємодія альдегідів з голубим осадом Cu(OH)2 при нагріванні і при цьому відбувається зміна кольорів: голубий→жовтий → червоний, утворюється карбонова кислота – якісна реакція на альдегіди
СН3 С(О)Н + Cu(OH)2 → СН3 СОOH + Cu+1OH + H2O
голубий жовтий
2CuOH → Cu2O + H2O
Червоний
Загальне рівняння:
СН3 С(О)Н + 2Cu(OH)2 → СН3 СОOH + Cu2O + 2H2O
голубий червоний
IІІ. реакція окиснення
1. реакція горіння:
Внаслідок реакції повного горіння альдегідів утворюється завжди СО2 і Н2О.
2С2Н4 О + 5О2 → 4CО2 + 4H2О
2. реакція окиснення розчином KMnO4
Альдегіди окислюються розчином KMnO4, знебарвлюючи його, і при цьому утворюються карбонові кислоти
О
Н С(О)Н + [О] → Н- С + Н2О
ОН
Метанова кислота, мурашина кислота
О
СН3 С(О)Н + [О] → СН3 - С + Н2О
ОН
Етанова кислота, оцтова кислота
Добування альдегідів
І. СН3 С(О)Н
У промисловості одержують:
- реакцією Кучерова:
С2Н2 + Н-ОН → СН3 С(О)Н
ІІ. Загальні методи добування
-реакція окиснення спиртів(переважно СuО):
C3H7 ОН + [О] → C2H5- С(O)H
Назва «Альдегід» означає «ал коголь дегід рогенізований».
1. Реакція лужного гідролізу дигалогеналканів (два галогени повинні знаходитись біля одного атома Карбону) в присутності водного! розчину лугу
Водн.р-н лугу
СН3 -CHCl2 + 2NaOH → CH3 С(О)Н + 2NaCl + Н2О
Застосування альдегідів
І. НС(О)Н
1. для одержання формаліну (в медицині і шкіряній промисловості);
2. для одержання пластмас (фенолформальдегідна смола);
3. для протруювання і дезінфекції насіння
ІІ. СН3 С(О)Н
1. для одержання оцтової кислоти;
Карбонові кислоти
Карбонові кислоти – це орг.сполуки, що містять характеристичну (функціональну) групу – карбоксильну- зв’язану з вуглеводневим радикалом або атомом Н.
Група - СООН або - 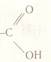 - карбоксильна група. Її назва складається з назв двох груп: карбо нільна (С=О) і гідро ксильна (ОН).
- карбоксильна група. Її назва складається з назв двох груп: карбо нільна (С=О) і гідро ксильна (ОН).
Загальна формула карбонових кислот: СnH2n+1 СООН де: n = 0,1,2,3,4 і
т.д. або R-СOОH, де R – Н, СН3, С2Н5, і т.д. aбо CnH2nO2 де: n = 1,2,3,4 і т.д.
Карбонові кислоти поділяються за:
І. вуглеводневим радикалом:
- насичені;
- ненасичені;
- ароматичні
ІІ. за кількістю груп СООН:
- одноосновні
- багатоосновні
Відмінність між формулою орг.кислоти і неорг.кислоти полягає в тому, що в органічних кислотах кислотний залишок знаходиться першим,а другим атом Н.
Наприклад: 1 2
[H] [NO3]
Кислотний залишок
2 1
[СН3СОО] [Н]
Кислотний залишок
Date: 2016-07-25; view: 553; Нарушение авторских прав