
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Застосування целюлози
|
|
1. для одержання глюкози, етилового спирту («гідролізний спирт»);
2. для одержання вибухівки (піроксилін), штучного волокна («ацетатний шовк», «мідно-аміачне волокно», «віскозне волокно»), деревне вугілля, метиловий спирт, оцтова кислота, ацетон;
3. деревина як будівельний матеріал і для виготовлення різних столярних виробів;
4. із бавовни, льону, коноплі виготовляють нитки, тканини, канати;
5. багато целюлози переробляють на папір і вату.
Нітрогеносмісні органічні сполуки
Тема 29. Аміни.
Аміни – це похідні від амоніаку, в якому один або всі почергово атоми Н заміщені на вуглеводневий радикал.
:::
NH3 ·N· + 3H· → Н:N:Н →:NH3 Н ─ N─Н R= CН3,
· Н │ С2Н5,
Н С3Н7 і
т.д.
Аміни поділяються:
І. за кількістю атомів Н заміщених на вуглеводневий радикал:
- первинні R-NH2;
- вторинні R-NH-R
- третинні R-N-R
│
R
ІІ. за вуглеводневим радикалом:
- насичені;
- ненасичені;
- ароматичні;
- змішані.(тільки вторинні і третинні)
Номенклатура амінів
За міжнародною або систематичною номенклатурою назви амінів походять відвідповідних назв алканів з додаванням закінчення - амін.
За історичною номенклатурою назви амінів походять від назв радикалів алканів з додаванням закінчення - амін
СН3- NH2 - метанамін, метиламін
(СН3)2 – NH - N-метилметанамін, диметиламін
(СН3)2 – N – С2Н5 - N,N – диметилетанамін, етилдиметиламін
СН3 – N – С3Н7 N– е тил-N- м етилпропанамін, е тил м ети п ропіламін
│
С2Н5
СН3 Група - NH2 - аміно- група
1 2 3│ 4
СН3- СН- С - СН3 3,3-диметилбутан-2-амін
│ │
NH2 СН3
Група - NH2 - аміно- група – є функціональна(характеристична) група амінів. Найбільш практичне значення серед амінів мають насичені і ароматичні аміни.
Насичені аміни
СН3- NH2 - метанамін, метиламін
(СН3)2 – NH - N-метилметанамін, диметиламін
За фізичними властивостями насичені аміни – це гази, добре розчинні у воді, мають різкий запах (NH3).
Хімічні властивості насичені аміни
За хімічними властивостями аміни подібні до амоніаку. У водному розчині амоніак утворює слабку основу - амоній гідроксид – слабку основу. Реакції відбуваються по неподільній парі електронів на атомі Нітрогену аміно-групи, подібно амоніаку у водному розчині аміни, даючи лужне середовище.
Отже, аміни – це органічні основи.
1. реакція з водою (по неподільній парі електронів атома Нітрогену)
NH3 + H2O ↔ [Н:NH3]+ OH- ↔ NH4+ OH-
↕ амоній гідроксид
Н+ + OH-
:NH3 + H2O ↔ NH4 OH; NH4+ - йон-амонію
NH4+ OH- ↔ NH4+ + OH-(лужне середовище)
NH4+ OH- - слабкий електроліт
СН3 -NH2 + H2O ↔ [СН3- NH3]+ OH- ↔ [СН3- NH3]+ + OH-
↕ метиламоній гідроксид лужне середовище
Н+ + OH-
2. реакція з кислотами (по неподільній парі електронів)
СН3 -NH2 + HCl ↔ [СН3- NH3]+ Cl-
↕ метиламоній хлорид
Н+ + Cl-
В реакціях з водою і кислотами аміни проявляють себе як органічні основи.
Насичені аміни проявляють сильніші основні властивості від амоніаку тому, що вуглеводневий радикал(наприклад, СН3 – метил) має властивість відштовхувати від себе спільну пару електронів до атома Нітрогену аміно-групи, таким чином збільшує негативний заряд на атомі Нітрогену і приєднання Н+ відбувається легше, ніж в амоніаку, бо в молекулі NH3 три атоми Гідрогену одинаково впливають на атом Нітрогену)
СН3 -NH2 + H2SO4 ↔ [СН3- NH3]+ HSO4-
метиламоній гідрогенсульфат
2СН3 -NH2 + H2SO4 ↔ [СН3- NH3]2+ SO42-
метиламонійсульфат
3. реакція горіння (подібно як реакція горіння амоніаку)
4NH3 + 3О2 = 6H2О + 2N2
4СН3 -NH2 + 9О2 = 4СО2 + 10H2О + 2N2
Ароматичні аміни
С6Н5- NH2 - бензенамін, феніламін, анілін.

За фізичними властивостями анілін – це рідина, нерозчинна у воді, дуже отруйна.
Ароматичні аміни є слабшими органічними основами (за амоніак) і за
насичені аміни тому, що фенільний радикал (С6Н5) має властивість відтягувати на себе спільну пару електронів від атома Нітрогену групи NH2, таким чином зменшує негативний заряд на атомі Нітрогені, а насичені аміни – навпаки, (група СН3 –метил) відштовхує від себе пару електронів, збільшуючи негативний заряд на атомі Нітрогену аміно-групи.
С6Н5- NH2 NH3 СН3- NH2
→ → → → → → → → → →
Зростає основність
В молекулі аніліну (подібно як толуені, фенолі) відбувається взаємний вплив груп одна на одну (С6Н5 і NН2)
І. реакції по групі NH2
1. реакція з водою.
Анілін не вступає в реакцію з водою.
2. реакція з кислотами (тільки з сильними кислотами).
С6Н5 -NH2 + HCl → [С6Н5- NH3]+ Cl-
феніламоній хлорид
ІІ. реакції по бензеновому ядрі (як аренів)
1. реакція галогенування (з «хлорною» чи «бромною водою») При цьому утворюється білий осад.
С6Н5-NН2 + 3Br2 → С6Н2(Br3) –NН2 ↓ + 3HBr
2,4,6-трибромоанілін
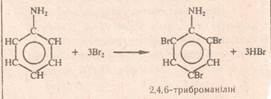
(анілін знебарвлює«бромну воду»)
2. реакція нітрування
k. H2SO4
С6Н5-NН2 + 3HO-NO2 → C6H2(NO2)3NН2 + 3H2O
2,4,6-тринітроанілін
ІІІ. реакція окиснення
1. реакція горіння
4С6Н5-NН2 + 31O2 → 24CO2 + 14H2O + 2N2
Добування амінів
1. реакція амінування моногалогеналканів.
Це взаємодія моногелогеналканів з амоніаком.
СН3 Cl + NH3 → СН3- NH2 + HCl
СН3 NH2 + CH3 Cl →(СН3)2 - NH + HCl
(СН3)2 - NH + CH3Cl → (СН3)3 - N + HCl
2. реакція нітровуглеводнів з воднем
СН3 NО2 + 3H2 → СН3 - NH2 + 2H2О
3. реакція нітробензену з воднем
внаслідок якої утворюється анілін називається реакція Зініна
С6Н5 NО2 + 3H2 → С6Н5 - NH2 + 2H2О
Застосування амінів(аніліну)
1. для виробництва барвників;
2. для синтезу лікарських речовин (сульфамідні препарати);
3. для одержання аніліно-формальдегідних смол і вибухових речовин.
Тема 30. Амінокислоти і білки.
Амінокислоти – це орг. сполуки, що містять дві функціональні групи: аміно (NH2) і карбоксильну (СООН), які зв’язані між собою хоча б через один атом Карбону.
NH2 – CH2 –COOH
Назви амінокислот походять від назв карбонових кислот. Тільки α-амінокислоти мають і біологічні назви.
2 1
NH2 – CH2 – COOH
α
2-аміноетанова кислота
α-амінооцтова кислота
Гліцин, Глікокол
2 1
NH2 – CH – COOH
α│
β3СН3
2-амінопропанова кислота
α-амінопропіонова кислота
Аланін
СН3
δ γ β α|
СН3─СН─СН─С ─СООН
5 4 | 3 2 | 1
NH2 СН3
γ-аміно-α,α-диметилвалеріанова кислота
4-аміно-2,2-диметилпентанова кислота
Амінокислоти містять одночасно NH2-групу (орг.основа) і СООН (орг.кислота), тому амінокислоти є амфотерні орг.сполуки
За фізичними властивостями амінокислоти – безбарвні кристалічні речовини, добре розчинні у воді, деякі з них солодкі на смак.
Хімічні властивості амінокислот
І. реакції по групі NH2-групу (як орг.основа)
1. реакція з кислотами
NH2 – CH2 –COOH + HCl → [NH3 – CH2 –COOH]+ Cl-
ІІ. реакції по групі СООН (як орг.кислоти)
1. реакція дисоціації
На відміну від карбонових кислот реакція дисоціації амінокислот відбувається одночасно і дисоціація амінокислот, і внутрішньо молекулярна нейтралізація, внаслідок якої утворюється диполярний йон (цвіттер-йон)
NH2 – CH2 –COOH ↔ NH2 – CH2 –COO- + Н+ ↔ +NH3 – CH2 –COO-
диполярний йон
2. реакція нейтралізації (реакція з лугами)
NH2 – CH2 –COOH + NaOH → NH2 – CH2 –COONa + H2O
Реакції амінокислот з кислотами і лугами одночасно підтверджує їх амфотерність.
3. реакція етерифікації
NH2 – CH2 –COOH + С2Н5ОН → NH2 – CH2 –COOС2Н5 + Н2О
ІІІ. реакція амінокислот між собою (тільки для амінокислот)
Амінокислоти взаємодіють між собою утворюючи пептиди.
NH2 – CH2 –COOH + NH2 – CH –COOH →
│
СН3
NH2 – CH2 – CO - NH – CH –COOH + Н2О
│
СН3
дипептид
Цією реакцією амінокислоти як амфотерні орг.сполуки відрізняються від амфотерних неорг.сполук (ZnO, Al2O3, Zn(OH)2, Al(OH)3).
Добування амінокислот.
1. реакція амінування моногалогензаміщених карбонових кислот
CH2 –COOH + NH3 → NH2 – CH2 –COOH + HCl
│
Сl
2. реакція гідролізу білків.
Застосування амінокислот
1. як будівельний матеріал для синтезу білків живих організмів;
2. для виготовлення лікарських речовин (штучні амінокислоти);
3. для підгодовлювання тварин.
Білки
Білки – це природні полімери ( біополімери), які складаються з великої кількості залишків α-амінокислот, що зв’язані між собою пептидним СО-NH зв’язком (пептидною групою). До складу більшості білків входять 200-500 амінокислотних залишків(можливо і з 1500 і більше)
Одержують білки реакцією поліконденсації α-амінокислот – це
сполучення великої кількості α-амінокислот з утворенням молекули білка і води.
n NH2 – CH –COOH → (- NH – CH –CO-)n + (n-1)H2O
│ │
R R
α-амінокислоти білок
Загальна формула білків:
(- NH – CH –CO-)n
│
R
Білки – це біологічно активні речовини («живі речовини» бо входять до складу живих організмів і можуть породжувати собі подібних). Білки за своєю природою є складні речовини і для них характерні такі структури:
1. первинна структура – це послідовність розміщення залишків (20) α-амінокислот у молекулі білка. Вона існує за рахунок пептидного зв’язку
(-СО – NH-).
2. вторинна структура – це скручування молекули білка у спіраль. Вона існує за рахунок водневих зв’язків, які утворюється між СО і NH групами двох паралельних витків цієї спіралі.
3. третинна структура – це скручування спіралі у глобулу (протомер). Вона існує за рахунок різних зв’язків: йонних, складноефірних(естерних), дисульфідних, гідрофобних.
4.четвертинна структура – це об’єднання кількох глобулу систему (мультимер). Вона існує за рахунок різних зв’язків, подібно як вторинні і третинні, тільки крім пептидного.
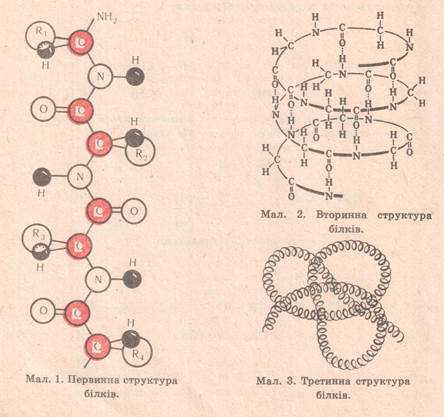

Починаючи з вторинної стуктури білки є біологічноактивні речовини («живі речовини»).
Хімічні властивості білків
1. денатурація білків – це руйнування аж до вторинної структури білка під дією таких факторів: температура, радіація, дія кислот і лугів, дія солей важких металів.
Денатурація білка є оборотній процес при нетривалій дії цих факторів, а при тривалій дії – необоротній.
2. ренатурація білків – це процес тимчасової втрати вторинної структури білка при наявності деяких факторів: солей легких металів (KCl, NaCl, NH4Cl), а при відсутності цих факторів знову поновлюється вторинна структура білків.
3. реакція гідролізу білків – це взаємодія білка з водою внаслідок реакціїутворюються амінокислоти. Каталізатором реакції гідролізу є розчини кислот або лугів, а в організмі людини – під дією ферментів.
Н+ або ОН-
(- NH – CH –CO-)n + (n-1)H2O → n NH2 – CH2–COOН
│ ферменти │
R R
Білок Амінокислоти
Гідроліз білків є процес деструкції, бо утворюються амінокислоти і немає вже білка.
4. кольорові реакції на білки.
А) ксантопротеїнова реакція – це дія на білок конц. HNO3, при цьому білок жовтіє. Цією реакцією визначають наявність у білка фенільного радикалу(С6Н5).
Б) біуретова реакція – це дія на білок голубим осадом Cu(OH)2 при цьому білок одержує фіолетове забарвлення. Цією реакцією визначають наявність в білках пептидної групи (СО-NH-).
В) цистеїнові реакція – це дія на білок Pb(NO3)2 при цьому білок чорніє. Цією реакцією визначають наявність в білках сульфідної групи (S).
Застосування білків
1. як будівельний матеріал живих організмів;
2. як харчовий продукт (штучна їжа);
3. як ліки (інсулін);
4. як добавки до кормів тварин.
Тема 31. Нуклеїнові кислоти.
Нуклеїнові кислоти – це природні полімери( біополімери), що складаються з великої кількості залишків нуклеотидів. Нуклеотиди в свою чергу складаються з трьох компонентів:
1. вуглеводний компонент (рибоза, дезоксирибоза);
2. нітрогеновмісна основа (азотиста): Урацил, Тимін, Цитозин, Гуанін, Аденін);
3. Фосфатна кислота (Н3РО4).
Нуклеїнові кислоти поділяються на:
1. ДНК;
2. РНК.
До складу ДНК входять нуклеотиди, що містять:
- дезоксирибоза;
- Тимін, Цитозин, Аденін, Гуанін;
- Н3РО4
До складу РНК входять нуклеотиди, що містять:
- рибоза;
- Урацил, Цитозин, Аденін, Гуанін;
- Н3РО4
Нуклеїнові кислоти більш складні за своєю природою від білків і для них характерні такі структури:
1. первинна структура – це послідовність розміщення залишків нуклеотидів у молекулі нуклеїнових кислот. Вона існує за рахунок фосфорскладноефірного зв’язку.
2. вторинна структура. Для ДНК вона існує у вигляді подвійної спіралі, що складається з двох молекул ДНК, які розміщені азотистими основами до середини і завжди комплементарно: А – Т і Г – Ц (А н Т он Ц и Г ан), а заишками фосфатної кислоти і дезоксирибозою на зовню. Вона існує за рахунок водневих зв’язків, які утворюються між азотистими основами двох паралельних витків.

Для РНК вона існує у вигляді однієї спіралі і не цілком спіралізована. Вона існує за рахунок водневих зв’язків, які утворюється між азотистими основами двох паралельних витків цієї спіралі і завжди комплементарно: А – У і Г - Ц.
3. третинна структура – це певне розміщення молекули ДНК у просторі. Вона існує у вигляді клубка, закрученої нитки. (ДНК має довжину 1,8 см хоча знаходиться в клітині).
Функції нуклеїнових кислот:
ДНК -передає спадкову інформацію.
РНК - бере участь в біосинтезі білка.
Тема 32. Високомолекулярні сполуки і полімерні матеріали на основі них..
ВМС
До високомолекулярних сполук відносяться складні речовини, що мають відносну молекулярну масу 5000 і більше.
Загальна формула ВМС: (-А-)n
Основні поняття хімії ВМС
nA → (-A-)n
nСН2 = СН2 → (-СН2-СН2-)n
етилен поліетилен
Мономер – це вихідні речовини в реакціх одержання ВМС. Наприклад: СН2 = СН2 - етилен.
Полімер – це продукти реакції одержання ВМС. Наприклад: (-СН2-СН2-)n - поліетилен.
Структурна(елементарна) ланка - це група атомів, яка багато разів повторюється у молекулі полімеру. Наприклад: -СН2-СН2-.
Ступінь полімеризації полімеру - це число, яке показує скільки разів елементарна ланка повторюється в молекулі полімеру. Наприклад: n
Молекули полімерів ще називають макромолекулами.
Реакції синтезу ВМС
1. реакція полімеризації – це реакція сполучення великої кількості однакових молекул мономерів з утворенням однієї макромолекули полімеру. Ці реакції характерні тільки для алкенів і алкадієнів (містять 2 подвійні зв′язки).
nСН2 = СН2 → (-СН2-СН2-)n
етилен поліетилен
nСН2 = СН – СН3 → (-СН2 - СН -)n
пропілен |
CН3 поліпропілен
2. реакція спів(ко)полімеризації -це реакція сполучення великої кількості різних мономерів з утворенням однієї макромолекули співполімеру. Ці реакції характерні тільки для алкенів і алкадієнів (містять 2 подвійні зв′язки).
nСН2 = СН2 + nСН2 = СН – СН3 → (-СН2-СН2-СН2 - СН -)n
│
СН3
3. реакція поліконденсації – це реакція сполучення великої кількості однакових або різних мономерів, з утворенням крім макромолекули полімеру і ще низькомолекулярні речовини (Н2О, N2, HCl).
n NH2 – CH –COOH → (- NH – CH –COO)n + (n-1)H2O
│ │
R R
α-амінокислоти білок
ВМС поділяються на такі групи:
1. пластмаси;
2. каучуки;
3. синтетичні волокна.
Пластмаси
Пластмаси поділяються на:
1. термопластичні пластмаси;
2. термореактивні пластмаси.
Термопластичні пластмаси – це пластмаси, які піддаються багаторазовій переробці. Наприклад:
1. поліетилен; (тефлон -(-СF2-СF2-)n )
2. поліпропілен;
3. поліхлорвініл(полівінілхлорид);
4. полістирол
Всі термопластичні пластмаси одержують реакціями полімеризації відповідних мономерів:
nСН2 = СН2 → (-СН2-СН2-)n
етилен поліетилен
(Застосування: пакувальний матеріал для харчових продуктів і виробів; покриття теплиць, оранжерей; водопровідні та каналізаційні труби)
nСН2 = СН – СН3 → (-СН2 - СН -)n
пропілен |
CН3 поліпропілен
(Застосування:труби гарячої води; пакувальний матеріал для технічних цілей)
nСН2 = СН → (-СН2 - СН -)n
│ |
Cl Cl
хлорвініл поліхлорвініл
(Застосування: лінолеум; замінники шкіри – дермантин; ізолента)
nСН2 = СН → (-СН2-СН-)n
| │
С6Н5 С6Н5
стирен полістирен (полістирол)
(Застосування: пінопласт; пакувальний матеріал для харчових продуктів і фармацевтичних виробів)
Термореактивні пластмаси – це пластмаси, які не піддаються багаторазовій переробці. Наприклад:
- фенол формальдегідна смола.
Термореактивні пластмаси одержують реакцією поліконденсації.
ОН
│
nС6Н5 –ОН + n Н - C= О → (-С6Н4- СН2 –)n + nH2O
фенол │ фенолформальдегідна смола
Н
Формальдегід

Фенолформальдегідна смола
(Застосування: дерев´яностружкові і дерев´яноволокнисті плити – ДСП і ДВП;
пластики; лаки для меблів)
Каучуки
Каучуки – це полімери, які одержують із дієнових вуглеводнів (алкадієнів) реакціями полімеризації їх.
Дієнові вуглеводні (алкадієни) – це ненасичені вуглеводні, які містять два подвійні зв’язки.
СН2 = СН – СН = СН2 СН2 = С – СН = СН2
Бута-1,3-дієн │
Дивініл СН3
2-метилбута-1,3-дієн
Ізопрен
nСН2 = СН – СН = СН2 → (- СН2 - СН = СН - СН2-)n
Бута-1,3-дієн бутадієновий каучук
Дивініл дивініловий каучук
СН2 = С – СН = СН2 → (- СН2 - С = СН - СН2-)n
│ │
СН3 СН3
2-метилбута-1,3-дієн ізопреновий каучук
Ізопрен
Для каучуків, як і для алкенів характерна цис-, транс-ізомерія:
Наприклад: (- СН2 - СН = СН – СН2 -)n Бутадієновий (дивініловий) каучук
-СН2 Н
(---- С = С ------)n
Н СН2-
Транс- бутадієновий
каучук
Н Н
(------ С = С --------)n
-СН2 СН2-
Цис- бутадієновий
каучук

Цис- ізопреновий каучук
Каучуки – це ненасичені полімери.
Каучуки використовуються для одержання гуми реакцією вулканізації – це взаємодія каучука з сіркою.
Волокна
Волокна поділяються:
1. природні;
2. штучні;
3. синтетичні.
До природних волокон відносяться:
- лляні;
- вовняні;
- бавовняні;
- шовкові.
До штучних волокон відносяться:
- віскозні;
- мідно аміачні;
- ацетатні (ацетатний шовк).
До синтетичних волокон відносяться:
- капрон;
- лавсан
Синтетичні волокна одержують реакцією поліконденсації відповідних мономерів.
nNH2-(CH2)5-COOH → (-NH-(CH2)5-CO-)n + (n-1)H2O
ε -амінокапронова кислота капрон
(капролактам)
Date: 2016-07-25; view: 552; Нарушение авторских прав