
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тема 8. Будова атома.
|
|
На початку XIX столітті вчені класифікували хім..елементи за такими ознаками:
1. метали і неметали
2. валентністю
3. родинами або групами подібних елементів.
Менделєєв Д.І.,вивчивши всі класифікації до нього, запропонував свою класифікацію. За основу її він взяв атомну масу хімічних елементів(постійну величину на той час) і розмістив всі елементи(їх було 63, а зараз більше 110) у порядку зростання їх атомних мас. Кожному елементу він дав свій номер, який назвав порядковим номером і одержав таблицю – періодичну систему - у кожному горизонтальному рядочку (періоді) повторюються певні закономірності:
1. металічні властивості спадають;
2. неметалічні властивості зростають;
3. Валентність в оксидах цих елементів зростає від І доVIII.
4. Валентність у гідрогенових сполуках тільки неметалів спадає від IV до І;
5. Властивості гідроксидів всіх елементів змінюються від основних
через амфотерні до кислотних.
На основі цих закономірностей Менделєєв вивів періодичний закон:
«Властивості хім.елементів, а також сполук утворених ними перебувають у періодичній залежності від їх атомних масс.»
У періодичній системі є відхилення від періодичного закону:
1. +18Ar - +19K
2. +27Co - +28Ni
3. +52Te - +53I
Причину цих відхилень Менделєєв вважав треба шукати в будові атомів хім..елементів.
Будова атома
Атом складається із позитивного ядра і негативно заряджених електронів, які рухаються навколо нього по електронних шарах (енергетичних рівнях або електронних орбіталях).
Атом0 = ядро+ + електрони-
Позитивно заряджене ядро складається із позитивних протонів і нейтральних нейтронів.
Ядро+ = протони+ + нейтрони0
Позначення елементарних частинок атома:
Протони: +11р; Нейтрони - 01n; Електрони: -10е; m (е) = ------ m(р або n)
(Масою -10е можна нехтувати)
Вся маса атома зосереджена в ядрі і визначається масою протона і нейтрона
Сума протонів і нейтронів (n + р) називається нуклони.
Вчені відкрили, що порядковий номер елемента – це числове значення заряду ядра цього атома.
Наприклад:
+ 19 39К, де: 39 – відносна атомна маса, а +19 –заряд ядра атома.
Порядковий номер елемента означає:
1. числове значення заряду ядра атома;
2. кількість протонів у ядрі;
3. кількість електронів у атомі.
Наприклад:
+ 19 39К (19p; 19e; n = 39 -19 =20)
+ 1 1H (1p; 1e; 0n); + 1 2 24Mg (12p; 12e; 12n)
Вчені відкрили, що майже всі елементи у природі існують у вигляді не менше двох різновидів і більше – ізотопів (нуклідів) – це різновиди одного і того ж елемента, які мають одинаковий заряд ядра, але різну атомну масу.
Наприклад:
+ 1 1Н - Протій; + 1 2Н – Дейтерій; + 1 3Н – Тритій.
+ 17 35Cl і + 17 37Cl
Відносна атомна маса елементів у періодичній системі – це середнє арифметичне атомних мас ізотопів цього елемента, враховуючи процент його у природі.
Існування ізотопів(нуклідів) елементів свідчить про те, що атомна маса не є постійна величина для хім..елемента, а постійною величиною є заряд ядра атома. Тому сучасне формулювання періодичного закону: «… від заряду ядра атома».
Існування ізотопів пояснює ще явище радіоактивності. Ізотопи ще відрізняються ще один від одного кількістю нейтронів у ядрі (починаючи з Полонію, кількість ізотопів збільшується до сотні і більше).
Радіоактивність – це перетворення одних елементів в інші, але при цьому виділяється такі частинки:
- α- частинки- 24Не;
- β- частинки - -10е
- +11р; 01n; γ – частинки.
Явища радіоактивності зображують ядерними реакціями:
- +46111Pd → +47111Ag + β (- 10е )
- +86222Rn → 84218Po + α (24Не)
Необхідно пам’ятати:
+86222Rn, де: 222- ще називають нуклонне число (відносна атомна маса)
+86 – протонне число (заряд ядра).
Завдання: Скільки різновидів молекул води може утворитися із нукліду Оксигену 16О і ізотопів Гідрогену 1Н, 2Н, 3Н?
Відповідь: 6. 1Н1Н16О; 2Н2Н16О; 3Н3Н16О; 1Н2Н16О; 1Н3Н16О; 2Н3Н16О.
Будова періодичної системи
Періодична система складається з:
- 7 періодів;
- VIII груп.
Періоди – це горизонтальні рядки хім..елементів, які починаються лужним металом і закінчуються інертним газом.
Періоди поділяються на:
- малі (1 – 3)
- великі (4 – 7)
Групи -це вертикальні рядки хім..елементів. в яких містяться родини подібних елементів.
Групи поділяються на підгрупи:
- головна;
- побічна.
Головна підгрупа – це підгрупа, що містить елементи як малих так і великих періодів. Головна підгрупа позначаєтьсябуквою А(а).
Наприклад: І-А – лужні метали (Li, Na, K, Rb, Cs, Fr)
Побічна підгрупа – це підгрупа, що містить елементи тільки великих періодів. Побічна підгрупа позначаєтьсябуквою В(в).
Наприклад: І-Б – Сu, Ag, Au.
Види електронів
В атомі ядро відповідає за масу атома і за позитивний заряд, а електрони – за властивості атома. Хіміків в атомі цікавить більше електрони, ніж інші частинки.
Відомі такі види електронів в атомі:
1. s – електрони: максимальна кількість – 2; починають заповнюватися з першого електронного шару; мають 1 форму руху (сферичну).
2. р – електрони: максимальна кількість – 6; починають заповнюватися з другого електронного шару; мають 3 форми руху (гантелеподібну).
S і p – електрони – це електрони внутрішніх шарів і тільки зовнішнього шару.
Елементи, які містять s і p – електрони, містяться тільки в головних підгрупах.
3. d – електрони: максимальна кількість – 10; починають заповнюватися з третього електронного шару; мають 5 форм руху.
d – електрони – це електрони передостаннього шару атома.
Елементи, які містять d – електрони, містяться тільки в побічних підгрупах.
4. f – електрони: максимальна кількість – 14; починають заповнюватися з четвертого електронного шару; мають 7 форм руху.
f – електрони – це електрони передпередостаннього шару атома.
Типи форм руху різних видів електронів:

Номер періоду для хім.елементів означає:
1. кількість електронних шарів для всіх елементів цього періоду;
2. вказує на номер зовнішнього шару
Номер групи для хім..елементів означає:
1. валентність (найвищу) е лементів в оксидахдля всіх елементів цієї групи;
2. вказує на кількість електронівзовнішньому електронному шарі тільки для елементів головних підгруп.
Електронні та електронно- графічні формули (конфігурації) елементів.
Наприклад:
+ 8 16О 1s22s22p4

+ 1 8 40Ar 1s22s22p63s23p6
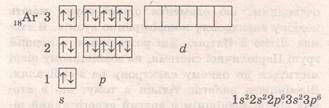
+ 26 56Fe 1s22s22p63s23p64s23d6
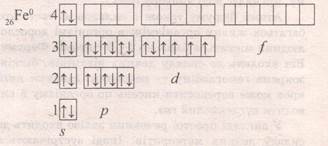
21 45Sc 1s22s22p63s23p64s23d1

Для атомів елементів характерний нормальний(стаціонарний) і збуджений стани.
Нормальний(стаціонарний) стан атома ми описуємо електронними (конфігураціями) формулами, користуючись періодичної системи.
Збуджений стан атома - це стан при якому є можливість спареним електронам тільки зовнішнього шару атома розпаровуватись на вільні електронні хмари тільки зовнішнього шару.
Наприклад:
+ 6 12С 1s22s22p2 нормальний стан

+ 6 12С 1s22s12p3 збуджений стан
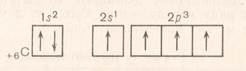
Електронні формули йонів елементів записуються таким чином:
1. для катіонів елементів – від електронної формули нормального стану атома елемента віднімаємо електрони тільки від зовнішнього шару
Наприклад: написати електронну формулу(конфігурацію) йону Калію (К+):
+ 19 39К0 1s22s22p63s23p64s1 нормальний стан
К0 - 1е → К+
+ 19 39К+ 1s22s22p63s23p64s0 йон - катіон
2. для аніонів елементів – до електронної формули(конфігурації) нормального стану атома елемента додаємо електрони тільки від зовнішнього шару
Наприклад: написати електронну формулу йону Хлору (Сl-):
+ 17 35,5Cl0 1s22s22p63s23p5 нормальний стан
Cl0 + 1е → Cl-
+ 17 35,5Cl- 1s22s22p63s23p6 йон - аніон
В елементах побічних підгруп переважно на зовнішньому шарі міститься 2 електрони, тільки для Хрому (Cr) і Купруму (Cu) тільки 1 електрон.
+24Cr 1s22s22p63s23p64s 1 3d 5
+29Cu 1s22s22p63s23p64s 1 3d 10
У періодах металічні властивості зменшуються, а неметалічні – збільшуються зліва на право.
У групах металічні властивості збільшуються, неметалічні - зменшуються
зверху донизу.
Радіус атомів у періодах зменшується із збільшенням порядкового номеру елементів, хоч кількість електронних шарів залишається однаковою (зростає позитивний заряд ядра і загальна кількість електронів)
Радіус атомів у групах збільшується із збільшенням порядкового номеру елементів, бо зростає кількість електронних шарів.
Вправи: Написати електронні та електронно-графічні формули(конфігурації) в нормальному та збуджених станів таких атомів елементів, а також для йонів (катіонів та аніонів): +33Аs, +14Si, +13Al, +34Se, +11Na, +15P, O2-, Al3+, F-, Ca2+.
Тема 9. Хімічний зв’язок і будова речовини.
Хімічний зв’язок поділяється на:
1. внутрішньо-молекулярний зв’язок (між атомами або йонами);
2. міжмолекулярний зв’язок.
Внутрішньомолекулярний зв’язок поділяється на:
1. ковалентний;
2. йонний;
3. донорно-акцепторний;
4. металевий.
Міжмолекулярний зв’язок поділяється на:
1. водневий зв’язок.
Загальні закономірності утворення хім.зв’язок:
1. Нейтральні атоми взаємодіють між собою за рахунок переважно неспарених електронів зовнішнього шару;
2. Щоб утворився хім. зв’язок між атомами кожен із них намагається завершити свій зовнішній шар до 8 електронів, крім атом Н до 2 електронів (подібно як інертні гази, які вже мають завершений зовнішній шар і не утворюють хім. зв’язку ні між собою, ні з іншими атомами):
Щоб краще зрозуміти механізм утворення хім.зв’язку необхідно ввести поняття «електронегативність елементів» -це властивість атомів одного елемента
відтягувати на себе електрони від іншого атома елемента. Електронегативність найбільш характерна для Неметалів і існує «Ряд електронегативності неметалів»: Si, H, P, S, Br, Cl, N, O, F
→→ → → → → → →
зростає електронегативність
Ковалентний зв’язок
Ковалентний зв’язок – це зв’язок між атомами тільки неметалів за допомогою спільних електронних пар.
Наприклад: Н2
Н· + ·Н → Н (:)Н
: НCl:
H· + ·Cl: → H (:) Cl:
::
Ковалентний зв’язок поділяється на:
1. ковалентний неполярний зв’язок -цезв’язок між атомами тільки однакових неметалів за допомогою спільних електронних пар і спільні електронні пари однаковою мірою належать обом атомам.
Наприклад: N2 , Cl2 , O3 , S8 , P4
2. ковалентний полярний зв’язок -цезв’язок між атомами тільки різнихнеметалів за допомогою спільних електронних пар і спільні електронні пари зміщені в бік більш електронегативного елемента.
Наприклад: H2O, NH3, H2SO4, C2H5OH.

1. s - s
2. s – p
3. p - p
Йонний зв’язок
Йонний зв’язок – це зв’язок між йонами металу і йонами неметалу.
Наприклад: NaCl
Na0 - 1e → Na+ Атоми Металів ніколи не приймають електрони на
Cl0 + 1e → Cl- зовнішній шар, а тільки віддають всі електрони із
зовнішнього шару, таким чином його зовнішнім шаром
стає передостанній, а він вже містить 8 елeктронів.
+11Na0 1s22s22p63s1 - 1e → Na+ 1s2 2s22p6 3s0
Йони – це заряджені частинки(катіони і аніони), в які перетворюються атоми при віддачі або прийомі електронів.
Необхідно пам’ятати:
Речовини, що містять у своєму складі Метал і Неметал завжди складаються із катіону Металу і аніону Неметалу.
Наприклад: NaOH, K2SO4, Al2O3, CH3COOK.
Донорно-акцепторний зв’язок
Донорно-акцепторний зв’язок (координаційний)– це зв’язок, який утворюється між двома різними неметалами при якому один із атомів дає у спільне користування пару електронів, а інший бере не даючи нічого.
Наприклад: йон-амонію (NH4+), йон-гідроксонію (Н3О+), аміни.
::
NH3 ·N· + 3H· → Н:N:Н →:NH3
· Н
:NH3 + HCl → →[Н:NH3]+ Cl → NH4+ Cl-
↕
Н+ + Cl-
Металічний зв’язок
Металічний зв’язок - це зв’язок, який характерний для металів і їх сплавів і утворюється за рахунок атомів Металів і йонів Металів, які попереміннозмінюються і вільних електронів, що рухаються між ними.
Водневий зв’язок
Водневий зв’язок - це міжмолекулярний зв’язок, який утворюється між деяким негативним атомом Оксисену однієї молекули і деяким позитивним атомом гідрогену іншої молекули.
Наприклад: HF, вода, спирт, карбонові кислоти, білки, нуклеїнові кислоти
Нδ+ ─ Оδ- ·· ·· Нδ+─ Оδ- ·· ·· Нδ+ ─ Оδ- ·· ·· Н ─ О вода
| | | |
Н Н Н Н
Нδ+─ Оδ- ·· ·· Нδ+ ─ Оδ- ·· ·· Нδ+ ─ Оδ- ·· ·· Н ─ О спирти
| | | |
R R R R
Кристалічні гратки речовин
Кристалічні гратки речовин - це правильне розміщення частинок (атомів, молекул, йонів), з яких складається речовина, у просторі речовини, що перебуває тільки у твердому кристалічному стані.
В залежності від частинок, з яких складається речовина кристалічні гратки поділяються на такі типи:
1. Молекулярна кристалічна гратка. Вона характерна для речовин з ковалентним полярним і неполярним зв’язками. При звичайних умовах речовини з молекулярною кристалічною граткою є газами або рідинами або твердими речовинами, які мають низькі температури кипіння чи плавлення.
(між молекулами існують слабкі зв’язки).
Наприклад: О2, Н2О, HNO3, органічні сполуки, Р4(білий фосфор)!
2. Йонна кристалічна гратка. Вона характерна для речовин з йонним зв’язками. При звичайних умовах речовини з йонною кристалічною граткою є тільки твердими речовинами, які мають високі температури плавлення і добре розчинні у воді(між йонами існують сильні зв’язки).
Наприклад: Основи, солі, оксиди металів.
3. Атомна кристалічна гратка (виняток). Вона характерна для речовин з ковалентним полярним і неполярним зв’язками. При звичайних умовах речовини з атомною кристалічною граткою є тільки твердими речовинами, які мають високі плавлення і дуже тверді..
(між атомами існують сильні ковалентні зв’язки).
Наприклад: тільки C, Si, SiC, SiO2, Р(червоний фосфор)!
Металічна кристалічна гратка. Вона характерна для речовин з металічним зв’язком. При звичайних умовах речовини з металічною кристалічною граткою є тільки твердими речовинами (крім ртуті), які мають переважно високі плавлення і дуже тверді (між атомами металів і катіонами металів, які поперемінно змінюються, і вільними електронами, які є спільними для всіх частинок у металах, існують міцні зв´язки).

Вправи: Визначити вид хімічного зв′язку і тип кристалічних граток для речовин, формули яких такі: Na2S; S8; C2H6O; Fe; SiC; KIO4; NaHCO3; CO2; BaCl2; Si; NH4Cl; C6H12O6.
Тема 10. Окисно-відновні реакції (ОВР).
Ступінь окиснення елемента (С.О.) – це число, яке показує кількість частково або повністю зміщених електронів від одного атома до іншого у формулі речовин.
С.О. елемента записується біля кожного елемента справа вверху (запис здійснюється таким чином: спочатку записується заряд, а потім число: Н+1,
О-2, Fe+3, Ca0) у формулі речовини. С.О. елемента стосується тільки одногоатома елемента у формулі речовини..
Правила визначення С.О. елементів у формулах речовин:
1. С.О. атомів Гідрогену (Н) у складних речовинах завжди дорівнює +1 (крім гідридів металів - NaH -1, CaH2-1, AlH3-1 ).
2. С.О. атомів Оксисену (О) у складних речовинах завжди дорівнює -2 (крім формул – H2 +1О2 -1, О+2F2-1 )
3. С.О. атомів Металів у складних речовинах завжди позитивний, а числове значення відповідає валентності.
4. С.О. атомів у простих речовинах завжди дорівнює 0.
5. Сума всіх позитивних С.О. елементів дорівнює сумі всіх негативних С.О. елементів у формулі речовини.
Наприклад: H2+1S+6O4-2; H3+1P+5O4-2; K2+1Cr+6O4-2;
+2 -8 +3 -8 +2 -8
Окисно-відновні реакції (ОВР) будемо розглядати, користуючись методом електронного балансу:
4Р0 + 5О20 = 2Р2+5О5-2
Р0 - 5е = Р+5 4 - реакція окиснення
О20 + 4е = 2О-2 5 – реакція відновлення
Р0 - відновник;
О20 - окисник.
Відновник – це елемент, який віддає електрони.
Окисник – це елемент, який приймає електрони.
Відновлення – це процес приймання електронів.
Окиснення – це процес віддачі електронів.
Відновник віддає електрони при цьому підвищує свій С.О. елементів, але сам при цьому окислюється.
Окисник приймає електрони при цьому понижує свій С.О. елементів, але сам при цьому відновлюється.
Якщо елемент має декілька С.О. то елемент з найменшою С.О. є тільки відновником, з найвищою С.О. – тільки окисником, а з проміжною С.О. –
і окисником, і відновником одночасно.
Наприклад:
С.О. S -2; │ 0; +4; │ +6
тільки відновник │ і окисник, і │ тільки окисник
відновник
ОВР поділяються на такі види:
1. Реакція міжмолекулярного окиснення і відновлення
2K+1 Mn +7O4-2 + 16H+1 Cl-1 = 2 Mn +2Cl2-1 + 2K+1Cl-1 + 5 Cl20 + 8H2+1O-2
Mn+7 + 5е = Mn+2 2 - реакція відновлення
2Cl-1 - 2е = Cl20 5 – реакція окиснення
Mn+7 - окисник;
Сl-1 - відновник.
2.Реакція внутрішньомолекулярного окиснення і відновлення
2K+1 Сl +5 O3 -2 = 2K+1 Cl-1 + 3 O20
Cl+5 + 6е = Cl-1 2 - реакція відновлення
2O-2 - 4е = O20 3 – реакція окиснення
Cl+5 - окисник;
O-2 - відновник.
3.Реакція самоокиснення і самовідновлення (диспропорціонування)
Cl20 + 6Na+1O-2H+1= 5 Na +1Cl-1 + Na+1Cl+5O3-2 + 3H2+1O-2
Cl20 + 2е = 2Cl-1 5 - реакція відновлення
Cl20 - 10е = 2Cl+5 1 – реакція окиснення
Cl20 - окисник і відновник
4. Реакція конпропорціонування
N-3H4N+3O2 = N02 + 2H2O
N-3 - 6е = N0 2 1 - реакція окиснення
N+3 + 6е = N02 1 – реакція відновлення
N-3 - відновник
N+3 - окисник
S+4O2 + 2H2S-2 = 3S0 + 2H2O
S+4 + 4е = S0 1 - реакція відновлення
S-2 - 2е = S0 2 – реакція окиснення
S+4 - окисник
S-2 - відновник
При чому реакції конпропорціонування також можуть бути внутрішньо (перший приклад) і міжмолекулярними (другий приклад).
Розгляд реакцій як ОВР методом електронного балансу використовується для урівнювання рівнянь реакцій, якщо класичним способом є неможливо.
Додаткові вправи:
Розглянути реакції як окисно-відновні методом електронного балансу, вказати окисник та відновник, реакції окиснення і відновлення:
1.⃰ Mg + HNO3 = Mg(NO3)2 + NH4NO3 + H2O
2.⃰ K2Cr2O7 + FeSO4 + H2SO4 = Cr2(SO4)3 + Fe2(SO4)3 + K2SO4 + H2O!
3. K Mn O4 = Mn O2 + K2MnO4 + O20.!
4. P4 + H2O = H3PO4 + H2
5. FeS2 + O2 = Fe2O3 + SO2 !
6. Hg + HNO3 = Hg2(NO3)2 + NO + Н2О!
7. K2MnO4 + H2O = MnO2 + KMnO4 + KOH.!
8. Fe + Fe2(SO4)3 = FeSO4
9. (NH4)2S + K2Cr2O7 + H2O = S + Cr(OH)3 + KOH + NH3
10. FeSO4 + O2 + H2SO4 = Fe2(SO4)3 + H2O
11. Hg + Hg(NO3)2 = Hg2(NO3)2
12. PbS + H2O2 = PbSO4 + H2O
13. H2O2 + KMnO4 + H2SO4 = O2 + MnSO4 + K2SO4 + H2O
14. Fe(CrO2)2 + O2 + K2CO3 = Fe2O3 + K2CrO4 + CO2
15. H3PO4 + Zn + H2SO4 = ZnSO4 + PH3 + H2O
16. CrCl2 + NO + HCl = CrCl3 + N2 + H2O
17. Al + KMnO4 + H2SO4 = Al2(SO4)3 + MnSO4 + K2SO4 + H2O
18. Br2 + Ca3P2 + H2O = HBr + Ca3(PO4)2
19. KMnO4 + FeSO4 + H2SO4 = Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
20. P2S3 + HNO3 = H3PO4 + H2SO4 + NO2 + H2O
21. KNO3 + S + C = K2SO4 + CO2 + N2
22. KNO3 + S + C = K2S + CO2 + N2.
23. C + CrO3 + H2SO4 = CO2 + Cr2(SO4)3 + H2O
24. CrO = Cr + Cr2O3
25. KBrO3 + KBr + H2SO4 = Br2 + K2SO4 + H2O
26. NH4NO3 = N2O + H2O
27. Ca + H2SO4 = CaSO4 + H2S + H2O
28. N2O + CO = N2 + CO2
29. HNO2 = NO + HNO3 + H2O
30. KH + H2O = KOH + H2
ІІ. Неорганічна хімія
Основні класи неорганічних сполук
Існують такі класи неорганічних сполук:
Оксиди;
Основи;
Кислоти;
4. солі.
Тема 11. Оксиди.
Оксиди – це складні речовини, що містять тільки два елементи, один з яких Оксиген.
Наприклад: СаО - кальцій оксид
СО2 - карбон (IV) оксид
Na2O - натрій оксид
Оксиди поділяються на такі класи:
1. солетворні;
2. несолетворні (індиферентні).
Солетворні оксиди поділяються:
1. основні;
2. кислотні;
3. амфотерні;
4. подвійні;
5. змішані.
Основні оксиди.
Основні оксиди – це оксиди тільки металів із валентністю І або ІІ і їм відповідають основи.
Наприклад: Na2O, CaO, FeO, CrO, МnO.
Хімічні властивості основних оксидів
1. Реакція з водою.
Деякі основні оксиди (тільки оксиди лужних та лужно-земельних металів) взаємодіють з водою, утворюючи луги.
K2O + H2O = 2KOH
CaO + H2O = Ca(OH)2
FeO + H2O ≠
1. Реакція з кислотами.
Всі основні оксиди взаємодіють з кислотами, утворюючи сіль і воду.
Реакція обміну.
FeO + 2HCl = FeCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O
2. Реакція з кислотними або амфотерними оксидами.
Всі основні оксиди взаємодіють з кислотними або амфотерними оксидами утворюючи сіль. Реакція сполучення.
Na2O + CO2 = Na2CO3
Кислотні оксиди
Кислотні оксиди - це оксиди всіх неметалів і деяких металів із валентністю VI і VII і їм відповідають кислоти.
Наприклад: СО2 - H2CO3 - карбонатна кислота
SO2 - H2SO3 - сульфітна кислота
SО3 - H2SO4 - сульфатна кислота
SiО2 - H2SiO3 - силікатна кислота
N2О5 - HNO3 - нітратна кислота
P2O5 - H3PO4 - ортофосфатна кислота
СrО3 - H2CrO4 - хроматна кислота
Mn2O7 - HMnO4 - перманганатна кислота
Хімічні властивості кислотних оксидів
1. Реакція з водою.
Всі кислотні оксиди (крім SiO2) взаємодіють з водою, утворюючи кислоти.
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
SiO2 + H2O ≠
2. Реакція з лугами.
Всі кислотні оксиди взаємодіють з лугами (розчинні основи – NaOH,
KOH, Ca(OH)2, Ba(OH)2) утворюючи сіль і воду.
SiO2 + Ba(OH)2 = BaSiO3 + H2O
N2O5 + 2KOH = 2KNO3 + H2O
3. Реакція з основними або амфотерними оксидами.
Всі кислотні оксиди взаємодіють з основними або амфотерними оксидами утворюючи сіль. Реакція сполучення.
Na2O + SO3 = Na2SO4
Амфотерні оксиди
Амфотерні оксиди – це оксиди деяких металів, які одночасно проявляють властивості і кислотних і основних оксидів і їм одночасно відповідають і основа, і кислота.
Наприклад: ZnO - Zn(OH)2 - H2ZnO2
BeO - Be(OH)2 - H2ВеO2
Fe2O3 - Fe(OH)3 - H3FeO3
Al2O3 - Al(OH)3 - H3AlO3
Cr2O3 - Cr(OH)3 - H3CrO3
Хімічні властивості амфотерних оксидів
1. Реакція з водою.
Амфотерні н оксиди не взаємодіють з водою
ZnO + H2O ≠
2. Реакція з кислотами.
Всі амфотерні оксиди взаємодіють з кислотами, утворюючи сіль і воду, подібно як основні оксиди. Реакція обміну.
ZnO + 2HCl = ZnCl2 + H2O
Al2O3 + 2H3PO4 = 2AlPO4 + 3H2O
3. Реакція з лугами.
Всі амфотерні оксиди взаємодіють з лугами, утворюючи сіль і воду подібно як кислотні оксиди.
ZnO + Ba(OH)2 = BaZnO2 + H2O
Al2O3 + 6KOH = 2K3AlO3 + 3H2O
4. Реакція з кислотними або основними оксидами.
Всі амфотерні оксиди взаємодіють з кислотними або основними оксидами утворюючи сіль. Реакція сполучення.
ZnO + CO2 = ZnCO3
Al2O3 + 3K2O = 2K3AlO3
Подвійні оксиди
Подвійні оксиди – це оксиди деяких неметалів (кислотні оксиди), яким відповідають по дві кислоти
Наприклад: → HN+3O2 - нітритна кислота
N+4O2 →
→ HN+5O3 - нітратна кислота
→ HCl+3O2 - хлоритна кислота
Cl+4O2 →
→ HCl+5O3 - хлоратна кислота
→ HCl+5O3 - хлоратна кислота
Cl+6O3 →
→ HCl+7O4 - перхлоратна кислота
Хімічні властивості подвійних оксидів
1. Реакція з водою.
Всі подвійні оксиди взаємодіють з водою, утворюючи по дві кислоти.
2СlO3 + H2O = HClO3 + HClO4
2. Реакція з лугами.
Всі подвійні оксиди взаємодіють з лугами, утворюючи дві солі і воду.
4NO2 + 2Ba(OH)2 = Ba(NO3)2 + Ba(NO2)2 + 2H2O
3. Реакція з основними або амфотерними оксидами.
Всі подвійні оксиди взаємодіють з основними або амфотерними оксидами утворюючи дві солі.
Na2O + 2ClO2 = NaClO2 + NaClO3
Змішані оксиди
Змішані оксиди – це оксиди деяких металів, що одночасно містять і основний і амфотерний оксид.
Наприклад: Fe3O4 (FeO·Fe2O3) - ферум(ІІ,ІІІ) оксид, залізна окалина
Для них характерна реакція тільки з кислотами, при цьому утворюються дві солі і вода.
Fe3O4 + 8HCl = Fe+2Cl2 + 2Fe+3Cl3 + 4H2O
(Fe+2O·Fe+32O3)
Fe3O4 + 4H2SO4 = Fe+2SO4 + Fe+32(SO4)3 + 4H2O
(Fe+2O·Fe+32O3)
Несолетворні (індиферентні) оксиди
Несолетворні оксиди – це оксиди деяких Неметалів, які не взаємодіють ні з кислотами, ні з лугами і не утворюють солей.
Наприклад: N2O, NO, CO.
Для них характерна реакція тільки з киснем (О2):
2СО + О2 = 2СО2
2NO + O2 = 2NO2
2N2O + O2 = 4NO
Добування оксидів.
1. Реакція речовин(простих і складних) з киснем.
С + О2 = СО2
2Н2S + 3O2 = 2SO2 + 2H2O
2. Реакція розкладу деяких кислот.
H2CO3 = CO2 + H2O
4HNO3 = 4NO2 + 2H2O + O2
3. Реакція розкладу нерозчинної основи.
Cu(OH)2 = CuO + H2O
4. Реакція розкладу деяких солей.
CaCO3 = CaO + CO2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Забарвлення деяких основних оксидів(металів):
1. CuO – чорний колір
2. Сu2O - червоний колір
3. Сr2O3 - зелений колір
4. Fe2O3 - бурий колір
Всі інші оксиди металів є білі тверді речовини.
Тема 12. Основи.
Основи – це складні речовина, які складаються з атомів металу і гідроксид-групи.
Наприклад.
NaOH - натрій гідроксид
Fe(OH)2 - ферум(ІІ) гідроксид
Основи поділяють за:
І. за розчинністю у воді:
1. розчинні або луги;
2. нерозчинні.
Луги є електролітами. Луги – це електроліти, які дисоціюють на йони-Гідроксиду(ОН-).
ІІ. За кількістю груп ОН:
1. однокислотні (NaOH, KOH);
2. багатокислотні (Fe(OH)2, Al(OH)3)
Хімічні властивості
І. Луги
1. Реакція зміни забарвлення індикаторів (реакція дисоціації)
Тільки розчинах лугів індикатори змінюють забарвлення:
Лакмус із фіолетового на синій
Метилоранж із оранжевого на жовтий
Універсальний індикатор із жовтого на синій
Фенолфталеїн із безбарвного на малиновий
NaOH ↔ Na+ + OH-
2. Реакція з кислотними або амфотерними або подвійними оксидами.
Тільки луги взаємодіють з кислотними або амфотерними або подвійними оксидами утворюючи сіль і воду.
2 NaОН + CO2 = Na2CO3 + Н2О
3. Реакція з кислотами.
Всі луги взаємодіють з кислотами, утворюючи сіль і воду. Реакція обміну,
а називається реакція нейтралізації – це реакція між основою і кислотою.
NaOН + HCl = NaCl + H2O
4. Реакція з солями.
Тільки луги взаємодіють з солями, якщо утворюється хоча б одна нерозчинна речовина. Реакція обміну.
Fe Cl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
KNO3 + NaOH ≠
CuSO4 + Ba(OH)2 = Cu(OH)2↓+ BaSO4↓
ІІ. Нерозчинні основи
1. Реакція з кислотами.
Всі нерозчинні основи взаємодіють з кислотами, утворюючи сіль і воду. Реакція обміну, а називається реакція нейтралізації.
Fe(ОН)2 + 2HCl = FeCl2 + 2H2O
2. Реакція розкладу при нагріванні.
Тільки нерозчинні основи при нагріванні розкладаються на оксид
металу і воду.
Cu(OH)2 = CuO + H2O
Добування основ
І. лугів.
1. Реакція лужних або лужно-земельних металів з водою.
2Na + 2H2O = 2NaOH + H2↑
Ca + 2H2O = Ca(OH)2 + H2↑
2. Реакція оксидів лужних і лужно-земельних металів з водою.
BaO + H2O = Ba(OH)2
ІІ. Нерозчинних основ.
1. Реакція лугів з солями.
Fe Cl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
Забарвлення деяких нерозчинних оcнов:
1. Cu(OH)2 – голубий колір
2. СuOН - жовтий колір
3. Fe(OH)2 - брудно-зелений колір
4. Fe(OH)3 – «бурий» осад
Всі інші основи(луги і нерозчинні) є білі тверді речовини.
Тема 13. Кислоти.
Кислот и – це складні речовина, які складаються з атомі Гідрогену і кислотного залишку.
Наприклад.
HCl - хлоридна кислота
H2 SO4 - сульфатна кислота
Кислоти поділяють за:
І. вмістом Оксисену в кислотному залишку:
1. безоксигенові (HCl, H2S)
2. оксигеновмісні (HNO3, H2SO4, H3PO4)
Кислоти є електролітами. Кислоти – це електроліти, які дисоціюють на йони-Гідрогену(Н+).
І. За кількістю атомів Гідрогену (Н):
3. одноосновні (HСl, HNO3);→
4. багатоосновні (H2SO3, H3PO4)
Хімічні властивості кислот
1. Реакця зміни забарвлення індикаторів (реакція дисоціації).
У розчинах кислот:
Лакмус із фіолетового на червоний
Метилоранж із оранжевого на червоний
Універсальний індикатор із жовтого на червоний
Фенолфталеїн не змінює
HCl ↔ H+ + Cl-;
2. Реакція з основними або амфотерними оксидами.
Кислоти взаємодіють з основними або амфотерними або змішаними оксидами утворюючи сіль і воду.
2 НCl + CаO = СaCl2 + Н2О
3. Реакція з основами.
Всі кислотии взаємодіють з основами, утворюючи сіль і воду. Реакція обміну, а називається реакція нейтралізації.
NaOН + HCl = NaCl + H2O
4. Реакція з солями.
Сильні кислоти (HCl, HBr, HI, HNO3, H2SO4, H3PO4) взаємодіють з солями, утвореними слабкими кислотами (H2CO3, H2SO3,H2SiO3, H2S, HF). Реакція обміну.
2H Cl + Na2CO3 = H2CO3 + 3NaCl
H2CO3 + NaCl ≠
5. Реакція з металами.
Кислоти взаємодіють з металами, які стоять у ряду металів до Н, утворюючи сіль і водень. Реакція заміщення.
Zn + 2HCl = ZnCl2 + H2↑
Cu + HCl ≠
Добування кислот
І. Безокигенові.
1. Реакція неметалів з воднем.
S + H2 = H2S↑; Cl2 + H2 = 2HCl↑;
2. Реакція сильних кислот з солями, утвореними слабкими кислотами
2H Cl + Na2S = H2S + 2NaCl
ІІ. Оксигеновмісних.
1. Реакція кислотних або подвійних оксидів з водою.
СO2 + H2O = H2CO3
2NO2 + H2O = HNO3 + HNO2
2. Реакція сильних кислот з солями, утвореними слабкими кислотами
2Na NO3 + H2SO4 = Na2SO4 + 2HNO3
Амфотерні гідроксиди
Амфотерні гідроксиди –це гідроксиди деяких металів, які одночасно проявляють властивості як кислот так і основ.
Наприклад:: Zn(OH)2 - H2ZnO2
Be(OH)2 - H2ВеO2
Fe(OH)3 - H3FeO3
Al(OH)3 - H3AlO3
Cr(OH)3 - H3CrO3
Хімічні властивості амфотерних гідроксидів
1. Реакція з кислотами.
Всі амфотерні гідроксиди взаємодіють з кислотами, утворюючи сіль і воду, подібно як основи. Реакція обміну.
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
Al(OH)3 + H3PO4 = AlPO4 + 3H2O
2. Реакція з лугами.
Всі амфотерні гідроксиди взаємодіють з лугами, утворюючи сіль і воду подібно як кислоти.
Zn(OH)2 + Ba(OH)2 = BaZnO2 + 2H2O
Н2ZnO2 або
Zn(OH)2 + Ba(OH)2 = Ва [Zn(OН)4]
Al(OH)3 + 3KOH = K3AlO3 + 3H2O
Н3AlO3 або
Al(OH)3 + 3KOH = K3 [Al(OН)6]
3. Реакція розкладу при нагріванні.
Амфотерні гідроксиди при нагріванні розкладаються на оксид
металу і воду, подібно як нерозчинні основи.
Zn(OH)2 = ZnO + H2O
Добування амфотерних гідроксидів
1. Реакція лугів з солями.
Fe Cl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
Тема 14. Солі.
Солі – це складні речовини, які складаються з атомів металу і кислотного залишку.
Наприклад:
AlCl3 - алюміній хлорид
Fe2(SO4)3 - ферум (ІІІ) сульфат
Солі поділяються на:
1. Середні(нормальні) солі (містять Ме + кислотний залишок);;
2. кислі солі (містять Ме + Н + кислотний залишок);
3. основні солі(містять Ме + ОН + кислотний залишок);
Cолі є електролітами. Солі – це електроліти, які дисоціюють на катіони металів і аніони кислотного залишку.
Хімічні властивості середніх солей
1. Реакція з кислотами.
Солі, утворені слабкими кислотами, взаємодіють з сильними кислотами, якщо утворюється нова сіль і нова кислота. Реакція обміну.
2H Cl + Na2CO3 = H2CO3 + 3NaCl
H2CO3 + NaCl ≠
2. Реакція з лугами.
Солі взаємодіють з лугами, якщо утворюється хоча б одна нерозчинна речовина. Реакція обміну.
Fe Cl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
KNO3 + NaOH ≠
3. Реакція з металами.
Солі, утворені слабкими металами, взаємодіють із сильними металами. (Сильні метали ті, які знаходяться лівіше у ряду металів).
Zn + CuCl2 = ZnCl2 + Cu
Cu + ZnCl2 ≠
4. Реакція з солями.
Солі взаємодіють між собою, якщо утворюється хоча б одна нерозчинна сіль.
ZnСl2 + Na2CO3 = ZnCO3 ↓ + 2NaCl
Cu(NO3)2 + NaCl ≠
Кислі солі.
Одержують кислі солі реакцією нейтралізації дво або триосновних кислот з
лугами. Na ОН + H2SO4 = NaHSO4 + H2O
натрій гідрогенсульфат
2Na OH + H2SO4 = Na2SO4 + 2H2O
Na OH + H3PO4 = NaH2PO4 + H2O
натрій дигідрогенортофосфат
2 Na OH + H3PO4 = Na2HPO4 + 2H2O
натрій гідрогенортофосфат
3 Na OH + H3PO4 = Na3PO4 + 3H2O
Назви кислих солей
Магній гідрогенкарбонат - Mg(HCO3)2
ферум (ІІІ) дигідрогенортофосфат – Fe(H2PO4)3
натрій гідрогенсульфід - NaHS
Основні солі
Одержують основні солі реакцією нейтралізації дво або трикислотних основ з кислотами.
Al( OH)3 + HCl = Al(OH)2Cl + H2O
алюміній дигідроксохлорид
Al( OH)3 + 2HCl = Al(OH)Cl2 + 2H2O
алюміній гідроксохлорид
Al( OH)3 + 3HCl = AlCl3 + 3H2O
Date: 2016-07-25; view: 558; Нарушение авторских прав