
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Идеал газ. Идеал газ күйінің теңдеуі.
|
|
Идеал газ деп молекулалар арасында өзара əсерлесу күштрі болмайтын,жеке молекулалар көлемі ыдыс көлемімен салыстырғанда өте аз жəне малекулалар арасындағы өзара соқтығысуы абсолют серпімді болатын газды айтады. Көптеген тəжірибелер бойынша қалыпты жағдайда (оттек,гелий), яғни төменгі қысымда жəне жоғарғы температурада нақты газдар қасиеті идел газ
қасиетіне сəйкес келеді.Молекула-кинетикалық теория ашылғанға дейін идеал газдар қасиетін сипаттайтын көптеген заңдылықтар болған.
Сондықтан газдар ыдысқа толтырылғанда, сол ыдыстың көлемін толық алып тұрады жəне ыдыс қабырғаларына белгілі бір қысым күшін түсіреді. XVII ғасырдың ортасында ағылшын ғалымы Р.Бойль (1627-1691) жəне француз физигі З.Мариотт (1620-1684) бір-біріне тəуелсіз жасалған тəжірибе қорытындыларынан,
температура тұрақты болғанда газ көлемінің (v) оның қысымына (p) тəуелді өзгеретінін тұжырымдады, яғни берілген газ массасы үшін тұрақты температурада оның қысымы көлеміне кері пропорционал өзгереді, яғни
PV= const, 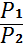 =
= 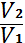 (1)
(1)
Бұлтəуелділікті изотерма деп аталатын гипербола қисығымен көрсетуге болады.
Газкүйінің бір күйден екінші күйге тұрақты температурада өтуі изотермиялық процес деп аталады. Ал нақты газдар бұл заңдылыққа тек тығыздықтары өте аз болғанда ғана бағынады. Сонымен,тұрақты температурада Рмен V тəуелділігі заттар қасиетін сипаттайды. Газ көлемінің (V) оның температурасына (Т) тұрақты.
қысымда (р=const) тəуелді болу шартын бірінші рет француз ғалымы Гей-Люссак (1778-1850) тағайындады: берілген газ массасы үшін қысымы тұрақты болғанда,газ көлемі оның температурасына сызықты тəуелді өзгереді:V= V0(1+ α vt°) (2)
Мұндағы V – газдың 0 C – тағы көлемі, V α– газдың көлемдік ұлғаюының термиялық коэффициенті. Тұрақтық қысымда газ көлемі мен температура тəуелділігі гракфикте түзу сызықпен көрсетіледі. Қысымның əрбір мəніне сəйкес келетін түзу сызық изобара деп аталады. Ал газ күйінің тұрақты қысымда өзгеруі изобаралық процесс делінеді. Тұрақты көлемде газ температурасының қысымға тəуелді болатыны да анықталады,яғни белгілі газдың массасы үшін көлемі тұрақты болғанда, газ қысымы оның температурасына сызықты тəуелділікке өзгеріледі.
Ρ = Ρ0 (1+αPt)(3)
мұндағы Ρ- газдың 0 C – тағы қысымы, ρα- газ қысымының термиялық коэффициенті. Көлем тұрақты болғанда, Ρмен t тəуелділігі түзу сызықты жəне ол изохора деп аталады(3-сурет). газ күйінің мұндай өзгеруі изохоралық процесс дейді. Зерттеудің нəтижелері газдардың термиялық коэффициенттері V αжəне ραбір-біріне шамалас екенін көрсетеді, яғни
αʋ=αp = α=  -1
-1
Изобара жəне изохора түзулері абсцисса өсінде шамасы t0= нүктесінде қиылысады. Температурасыны бастапқы санау нүктесін осы нүктеге ауыстырып, температурасының Цельсии шкаласынан абсолют кельвин шкаласы деп аталатын басқа температуралық шкалаға өтуге болады. Бірліктердің халық аралық жүйесінде Кельвин – температурасының термодинамикалық шкаласында негізгі өлшем болып, су күйінің үштік нүктесіне сəкес келетін термодинамикалық температураның I/273,15 нлесіне тең болады.
Абсолют температура Т мен Цельсии бойынша анықталған t температурасының арасында мынандай қатынас болады. Мысалы, 00 C -қа + 273,15 К сəкес келеді. 00 K –қа тең температура абсолют нөл деп аталады, оған − 273.150 C мəні сəйкес келеді. Енді (2) жəне (3) теңдеулерге абсолют температураның мəнің қойып, оны басқа түрде жазуға болады
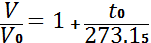 немесе
немесе 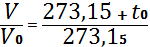
Бұдан 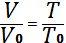
Егер 0 T мен 0 V тұрақты шама екенін ескерсек, онда изобаралық процесс үшін:
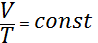 (4)
(4)
Осындай əдіспен изохоралық процесс үшін де мынадай теңдікті жазуға болды, яғни
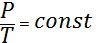 (5)
(5)
Авогадро тағайындаған заң бойынша бірдей жағдайларда, яғни бірдей
температура мен қысымда барлық газдардың модельдерінің көлемі бірдей болады.Қалыпты жағдайда:Ρ =1,013 *105 Па; Т=273,15К болса, оның көлемі
V = 22,41*10−3 м 3 / моль − ге тең
Əр түрлі заттарындың бір мольдегі молекулалар саны бірдей
болады: N = 6,022 *1023 моль −1 A, бұл Авагадро саны деп аталады.
Ағылшын физигі жəне химигі Дж.Дальтон (1766-1844) тағайыңдаған заң бойынша,
идеал газдар қоспасының жалпы қысымы,сол қоспаны құрайтын газдардың парциал қысымдарының қосындысына тең болады, яғни
Ρ = 1 Ρ + 2 Ρ + 3 Ρ + … + n Ρ (6)
Мұндағы 1 Ρ + 2 Ρ + 3 Ρ + ⋅⋅⋅+ n Ρ -парциал қысымдар. Сонымен идеал газдың берілген массасы үшін (m=const) жоғарыда қарастырылған
заңдылықтар, яғни:Ρ V =const (изотермиялық процесс), V / T =const (изобаралық процесс), P/T=const (изохоралық процесс) дұрыс екен.
27. Iшкi энергия. Жылу мөлшері және термодинамикалық жұмыс.
Iшкi энергия.
Макроденелер механикалық энергиямен қатар, өздерiнiң iштерiне тұйықталған энергияға ие. Ол – iшкi энергия. Ол барлық энергетикалық түрленулердiң балансына кiредi. Механикалық жұмыс жасамай-ақ денелердi қыздырғанда, олардың iшкi энергиясы ұлғаяды. Iшкi энергияның механикалық энергияға айналуының керi процесi болатыны сөзсiз. Молекулалық-кинетикалық теория көзқарасынан макроскопиялық дененiң iшкi энергиясы барлық молекулалардың ретсiз қозғалыстарының кинетикалық энергиялары мен олардың бiр-бiрiмен өзара әсерiнiң потенциалдық энергияларының қосындысына тең.
Термодинамикадағы жұмыс. Термодинамикада қозғалыстағы ортаның аз бөлшектерiнiң бiр-бiрiне қатысты орын ауыстыруы ғана қарастырылады. Нәтижесiнде дене көлемi, оның iшкi энергиясы өзгередi. Дене жылдамдығы тұтасымен алғанда нөлге тең болып қалады. Жұмыс классикалық механикадағы сияқты анықталады, бiрақ ол дененiң кинетикалық энергисының өзгеруiне емес, оның iшкi энергиясының өзгеруiне тең болады. Мысалы, газдардың сығылуы кезiнде поршень өзiнiң механикалық энергиясының бiр бөлiгiн газдарға бергендiктен, молекулалардың кинетикалық энергиясы ұлғаяды, газ қызады. Керiсiнше, егер газ ұлғайса, онда алыстаған поршенмен соқтығысқаннан кейiн молекулалардың жылдамдығы азайып, газ суиды.
Жұмысты есептеу. Қозғалмалы ортаның көлемi өзгергендегi iстелген жұмыс мынаған тең болады
А ′ = p · (V2-V1) = p · ΔV. (1)
Меншікті жылу сыйымдылығы с заттың физикалық қасиеттеріне қалай байланысты болса,жылу алмасуы жүретін процестің түріне де солай байланысты болады.
Буға айналудың меншікті жылуы.Сұйықты буға айналдыру үшін оған белгілі бір жылу мөлшерін беру қажет.
1 кг сұйықты тұрақты температурада буға айналдыру үшiн қажет болатын жылу мөлшерiн заттың буға айналуының меншiктi жылуы деп атайды. Бұл шама r символымен белгiленедi және СИ жүйесiнде Дж/кг -мен өлшенедi.
Массасы m сұйықты буға айналдыру үшiн мынадай жылу мөлшерi қажет:
Qбу = r · m. (3)
Конденсация кезiнде дәл сондай жылу мөлшерi бөлiнедi: Qбу = - rm.
Балқудың меншiктi жылуы. Дене тұрақты температурада балқиды. Молекулалардың кинетикалық энергиясы өзгермейдi, барлық берiлетiн жылу олардың потенциалдық энергиясын ұлғайтуға шығындалады.
1 кг затты сол температурадағы сұйыққа айналдыруға қажет болатын жылу мөлшерiн балқудың меншiктi жылуыλ (Дж/кг) деп атайды.
Массасы m болатын кристаллдық дененi балқыту үшiн мынадай жылу мөлшерi қажет:
Qбал = λ · m (4)
Жылу балансының теңдеуi. Тұйық жүйедегi жылу алмасу кезiнде, оның iшкi энергиясының қосындысы өзгермейдi. Кез келген жеке алынған дененiң энергиясының өзгерiсi жылулық тепе-теңдiк басталғанға дейiнгi дененiң берген немесе алған жылу мөлшерiне тең: ΔUi = Qi. Барлық денелер үшiн бұл шамаларды қосып және жүйенiң жинақталған iшкi энергисы тұрақты екенiн ескерiп, мынаны аламыз: ΔU1 + ΔU2 + ΔU3 +... = 0. Бұдан мына теңдеу шығады:
Q1 + Q2 + Q3 +… = 0. (5)
Бұл теңдеу жылу балансының теңдеуi деп аталады. Мұндағы Q1, Q2, Q3,..- жылу алмасу процесi кезiндегi дененiң берген немесе алған жылу мөлшерлерi. Олар жоғарыда көрсетiлген формулалармен өрнектеледі.
28.Термодинамиканың бірінші бастамасы
Ішкі энергия негізінен екі түрлі процестің: дененің А жұмыс істеуі мен денеге берілген Q жылу мөлшерінің есебінен өзгере алады. Жұмыс істеу системаға әсер етуші сыртқы денелердің орын ауыстыруымен қоса жүреді. Мәселен, ыдыстағы газды жауып тұрған поршень орын ауыстыруға отырып қозғалған кезде газ А жұмыс істейді. Ньютонның үшінші заңы бойынша бұл кезде газ да жұмыс жасайды: А= -A'.
Денеге жылу беру сыртқы денелердің орын ауыстыруымен тәуелді емес, демек, денеге жасалған микроскопиялық жұмысқа да тәуелді емес. Ішкі энергияның бұл жағдайдағы өзгерісі ыстығырақ дененің жеке молекулаларының салқынырақ дененің молекулаларына қарсы істеген жұмысының әсерінен болады. Бұл жағдайда энергия сәуле шығару арқылы да беріле алады. Бір денеден екінші денеге энергияның берілуіне әкелетін микроскопиялық процестердің жиынтығы жылу берілу деп аталады.
Бір дененің екінші денеге беретін энергия мөлшерінің дененің бір біріне істететін А жұмысы арқылы анықталатыны тәрізді, бір денеден екінші денеге ждылу берілу арқылы берілетін энергия мөлшері, дененің алатын Q жылу мөлшері арқылы анықталады. Сонымен, системаның ішлі энергиясының өсімшесі системаға істелген А' жұмыс пен системаға берілген жылудың қосындысына тең бодуы тиіс: U2 – U1 = Q + A'. (1)
Мұндағы U1 және U2 системаның ішкі энергиясының бастапқы және ақырғы мәндері. Әдетте, сыртқы денелердің системаға істелген А жұмысының орнына системаның сыртқы денелерге істеген А(-А' жұмысқа тең) жұмысын алады. А' орнына –Аны қойып және де теңдеуді Qға қатысты шешіп мынадай түрге келтіруге болады:Q = U2 – U1 + A.(2)
Бұл теңдеу энергияның сақталу заңын өрнектейді, әрі термодинамиканың бірінші заңы болып саналады. Оны былай айтуға болады: системаға берілген жылу мөлшері системаның ішкі энергиясының өсімшесіне және системаның сыртқы денелерде атқаратын жұмысына жұмсалады.
Бұл айтылғаннан, жылу берілген кезде әрқашан да системаның ішкі энергиясы артады екен деп түсінуге болмайды. Системаға жылу берілгенмен де оның энергиясы артпай, кемуі мүмкін. (U2 < U1) Бұл жағдайда формула бойынша A>Q немесе система жұмысты алынған Q жылу есебінен де кемуі U2 – U1ге тең ішкі энергияның қоры есебінен де істеуі мүмкін.Сондай ақ бұл теңдеудегі Q мен А шамаларының алгебралық екендігін ескеру керек. Жылу мөлшері жұмыс несеме энергия өлшенетін бірліктермен өлшенеді. СИ системасында жылу мөлшерінің бірілігі джоуль болып табылады.
Системаның істеген жұмысын немесе системаның алған жылуын есептегенде қарастырылып отырған процесті әдетте әрқайсысы системаның параметрлерінің азғантай ғана өзгеруіне сәйкес келетін бірнеше жай элементар процестерге бөлуге тура келеді. (2) теңдеуі элементар процесс үшін Δ Q = Δ U + Δ'A (3) түрінде жазылады, мұндағы Δ 'Q элементар жылу мөлшері, Δ'A элементар жұмыс және Δ U осы элементар процесс кезіндегі системаның ішкі энергиясының өсімшесі.
Δ 'Q және Δ'A Q және A шамаларының өсімшесі ретінде санауға болмайтындығын ескерген жөн. Бір күйден екінші күйге өтуге сәйкес келетін ∑ Δ f системасының өту жолына тәуелсіз болатын, яғни f шамасы күй функциясы болатын жағдайда элементар процеске сәйкес келетін қандай да бір шамасын осы шаманың өсімшесі деп қарауға болады. Күй функциясын айтқанда оның әрбәр күйдегі қоры жайында айтуға болады. Мәселен, әр түрлі күй жағдайларындағы системаның ішкі энергиясының қоры жайында айтуға болады.
Алда көретініміздей системаның істеген жұмысы мен системаның алған жылу мөлшерінің шамасы системаның бір күйден екінші күйге өту жолына тәуелді болады. Демек, Qда Aда күй функциясы емес, сондықтан да системаның әр түрлі күй жағдайындағы жылуының немесе жұмысының қоры жайлы айтуға болмайды. Сонымен, A және Q шамаларының алдындағы Δ символы U шамасының алдындағы Δ символынан басқаша мағына береді. Осы жағдайды баса көрсету үшін, бірінші жағдайдағы Δ штрихпен белгіленеді. Δ U символы ішкі энергияның өсімшесін білдіреді, ал Δ 'Q және Δ 'A символдары жылу мен жұмыстың өсімшемі емес, элементар жілу мен жұмыс мөлшерлерін білдіреді.
Есептеулер жүргізу үшін (3) теңдеуді дифферециал түрінде жазамыз. Сонда бірінші бастама теңдеуі мынадай болады: d'Q = dU + d'A. (4)
Тұтас процесс бойынша интегралдау Q = (U2 – U1) + A өрнегіне келтіреді, бұл өрнек (2) теңдеуімен тең.Осындай түрде жазылғанда термодинамиканың бірінші бастамасы мынадай пікірді білдіреді:системаға берілген жылу оның ішкі энергиясын арттыруға және система тарапынан сыртқы денелерге түсетін күштер өндіретін жұмысқа жұмсалады.Энергияның сақталу заңын (термодинамиканың бірінші бастамасын) тағайындау тарихи жағынан алғанда мынадай бір жағдаймен, атап айтқанда: энергияның ешбір түрін де жұмсамай және сырттан жылу алмай жұмыс өндіретін машина жасау талаптарының сәтсіздікке ұшырап отырғандығымен байланысты болған еді.Термодинамикада мұндай машина бірінші түрдегі перпетуум мобиле деп аталады.Жылу беру дегеніміздің өзі энергия беру деген сөз болғандықта, жалпы түрде энергия беру деп айтып энергияның сақталу заңын (термодинамиканың бірінші бастамасын) мынадай түрде тұжырымдап айтуымызға болады: бірінші түрдегі перпетуум мобиле, яғни периодпен істеп, бір периодының ішінде өндірітін жұмысы өзінің сырттан алатын энергиясының мөлшерінен артық болатын двигатель жасау мүмкін емес.
29. Изопроцесстер және олардың графиктері


Параметрлерiнiң бiрiнiң шамасы өзгерiссiз өтетiн процестердi изопроцестер деп атайды. Газдың үшiншi параметрi тұрақты болған кездегi екi параметрi арасындағы мөлшерлiк байланысты (тәуелдiлiктi) газ заңдары деп атайды.
Идеал газ күйiнiң теңдеуiне сүйенiп изопроцестердiң негiзгi түрлерiнiң физикалық құбылыстарын қарастырайық.
Температура тұрақты болған кезде термодинамикалық жүйе күйiнiң өзгеру процесiн изотермиялық процесс деп атайды. Бұл процесс Бойль - Мариотт заңмен жазылады:
PV = const
Газ температурасын тұрақты ұстау үшiн, оның температурасын өзгертпейтiндей етiп жылуалмасып тұратын жүйе – термостат қажет. Әйтпесе, газ сығылғанда немесе созылғанда оның температурасының өзгерiсi елеулi.Изотермиялық процестiң (P,V) жазықтығындағы графигi, мзотерма деп аталатын, гиперболаны бередi (1.10 - сурет).
|
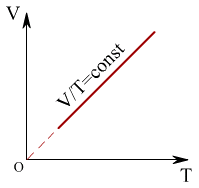
Қысым тұрақты болған кезде термодинамикалық жүйе күйiнiң өзгеру процесiн изобаралық процесс деп атайды. Егер ыдыста газ қысымы тұрақты болуы үшiн, оның қабырғалары жылжымалы (қозғалмалы) болуы керек. Изобаралық процестiң (V,Т) жазықтығындағы графигi, мзобара деп аталатын, түзу сызықты бередi (1.11 – сурет)
Көлем тұрақты болған кезде термодинамикалық жүйе күйiнiң өзгеру процесiн изохоралық процесс деп атайды. Егер газ герметикалық ыдыста болса, онда газ көлемi тұрақты болады. Изохоралық процестiң (P,T) жазықтығындағы графигi, мзохора деп аталатын, түзу сызықты бередi (1.12 - сурет)
30.Идеал газдың жылусыйымдылығы. Карно циклы. Карно теоремасы.
Идеал газдың молекулалары қашықтықтан әрекеттеспейтін болғандықтан, мұндай газдың ішкі энергиясы жеке молекуллардың энергияларының қосындысынан тұрады. Демек, идеал газдың бір киломольның ішкі энергиясы Авогадро санын бір молекуланың орташа энергиясына көбейткенге тең:
Ukм =NA2 =  NAkT=
NAkT= 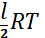 (1)
(1)
Массасы m газдың ішкі энергиясы газдың бір молінің энергиясын m массадағы киломолдердің санына көбейткенге тең болады:
U= 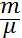 Ukм=
Ukм= 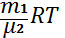 (2)
(2)
Қандай да бір дененің жылу сыйымдылығы деп оның температурасын бір градусқа көтеру үщін керекті жылу мөлшеріне тең шаманы айтады. Егерде денеге берілген d'Q жылу мөлшері оның температурасын dТ шамасына арттыратын болса, анықтама бойынша жылу сыйымдылық: Cдене= 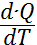 (3)
(3)
Бұл шаманың өлшем бірлігі дж̸град. Заттың киломолінің жылу сыйымдылығын С әрпімен белгілейміз.С нің өлшем бірлігі дж̸град∙ кмоль.
Заттың бірлік массасының жылу сыйымдылығы меншікті жылу сыйымдылық деп аталады. Оны біз с әрпімен белгілейміз, өлшем бірлігі дж̸град∙ кг
Заттың киломолінің жылу сыйымдылығы мен осы заттың меншікті жылу сыйымдылығының арасында төмендегідей қатынастың болытыны анық: c=C/μ (4)
Жылу сыйымдылығының шамасы денені қыздыру шарттарына тәуелді болады. Қыздыруды көлем немесе қысым тұрақты болған жағдайда жүргізгендегі жылу сыйымдылықтың айрықша маңызы бар. Бірінші жағдайда жылу сыйымдылық- тұрақты көлем кезіндегі жылу сыйымдылық (Сν деп белгіленеді), екінші жағдайда – тұрақты қысым кезіндегі жылу сыйымдылық (Сρ деп белгіленеді) деп аталады.
Егер қыздыру тұрақты көлем кезінде болатын болса, онда дене сыртқы денелерге қарсы жұмыс жасамайды, сондықтан термодинамиканың бірінші бастамасы бойынша барлық жылу дененің ішкі энергиясын арттыруға жұмсалады: d´Qv=dU (5)
Бұл өрнекте көлем тұрақты болған кезде кез келген дененің жылу сыйымдылығының мынадай болатындығы шығады: Cv= 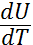 (6)
(6)
Демек, тұрақты көлемде идеал газдың киломолінің жылу сыйымдылығын алу үшін газдың ішкі энергиясының (1) өрнегін температура бойынша дифференциялдау керек:
Осы өрнектен көріп отырғанымыздай, тұрақты көлемде идеал газдың жылу сыйымдылығы газ күйінің параметрлеріне, олардың ішінде температураға, тәуелсіз тұрақты шама болып шықты. Осы өрнекті ескерсек, идеал газдың ішкі энергиясының өрнегі мынадай болады: Ukм =CvT (8)
Егер газды қыздыру тұрақты қысымда өтетін болса, онда газ ұлғаяды да сыртқы денелерге оң жұмыс жасайды. Демек, бұл жағдайда газдың температурасын бір градусқа арттыруға тұрақты көлем кезіндегіге қарағанда жылу керек болады, өйткені жылудың бір бөлігі газдың істейтін жұмысына кетеді. Сондықтан, тұрақты қысымдағы жылу сыйымдылық тұрақты көлемдегі жылу сыйымдылықтан артық болуы керек.
Карно циклы.
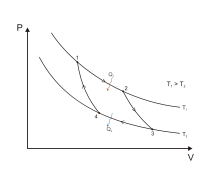 Сурет:Карно циклы.
Сурет:Карно циклы.
Карно циклы: a)- тік; б)- кері.
Карно циклы екі изотермиядан 1-2 және 3-4 және екі адиабаттан 2-3 және 4-1 тұрады.1-2 жолының жылуберуші тұрақты температураға T1, мөлшерлі жылулық (q1) жеткізіледі, 3-4 жолымен (q2) жылулық T2 тұрақты температурасымен жылу алмастырушыға алып кетіледі. Kepi Карно циклын іске асыру үшін, барлығы екі жылулық көзі қажет - жылу беруші және жылу қабылдағыш.Изотермиялық процесстегі, меншікті жылулық мөлшері q1 формулаға сәйкес жазылады:
· q1 = RT1 ln(V2/V1)
· q2 = RT2 ln(V3/V4)
Бұл теңдеуден 2-3 адиабаттар үшін табамыз:
· T2/T1 = (V2/V3)k-1
Ал, теңдеу 4-1 адиабаттар үшін:
· T2/T1 = (V1/V4)k-1
Бұдан, V2/V1 = V1/V4 немесе V2/V1 = V3/V4
Жылудинамикасының бірінші заңына сәйкес, алынған l меншікті жұмыс эквивалентті, яғни q1 - q2 = l, ал формулалар Карно пропорциясы деп аталуымен анықталады:q1/T2 = q2/T2
Бұдан:l = q1(1 - q2/q1) = q1(1-T2/T1).
Карно, шексіз жай ағатын (үйкелістен жоғалуы) 1-2-3-4 процессті қарастырған, сол себептен жұмысшы заттар механикалық тепе-теңдікте болады. Бұдан басқа, жұмыстық денемен температура көзі Т1 арасындағы, 1-2 изотерма бойында және Т2, 3-4 бойында шексіз аздаған температура айырмашылығы бар. Сонымен, термиялық тепе-теңдік сақталады. Сондықтан, цикл, қайтымды деп саналады. Бұл циклды, Карноның идеалды циклы деп атайды.
Карно теоремасы.
Бірінші теоремасы:жылулық қозғалтқыштың пайдалы әсер коэффициенті туралы теорема. Оны француз оқымыстысы Н.Л.С. Карно (1796 – 1832) тұжырымдаған (1824). Карно теоремасы бойынша Карно циклінің пайдалы әсер коэффициенті [η=(T1–T2)/T1, мұндағы T1 – қыздырғыштың температурасы, T2 – суытқыштың темп-расы] жұмыстық дененің табиғатына және жылулық қозғалтқыштың құралымына тәуелді болмайды, ол тек қыздырғыш (T1) пен суытқыштың (T2) температураларымен ғана анықталады. пайдалы әсер коэффициенті термодинамиканың екінші бастамасын тұжырымдау кезінде маңызды рөл атқарды;
Екінші теоремасы:соққы теориясында – абсолют серпімсіз соққы кезіндегі кинетикалық энергияның кемуі жайлы теорема.Соққы кезіндегі жүйенің кинетикалық энергиясының кемуі, жүйе нүктелерінің кеміген жылдамдықпен қозғалған кезіндегі кинетикалық энергиясына тең.
31. Пайдалы әсер коэффициенті. Термодинамиканың екінші бастамасы.
Термодинамиканың екінші бастамасы — статистикалық нысандардың (мысалы, атомбеидардың, молекулалардың) үлкен санынан тұратын жүйелердің өз бетінше ықтималдығы аздау күйден ықтималдығы молырақ күйге ауысу процесін сипаттайтын табиғаттың түбегейлі заңы. Термодинамиканың бірінші бастамасы бойынша энергия сақталады. Энергияның сақталу заңы орындалатын, бірақ табиғатта бақыланбайтын коптеген процестерді кездестіруге болады. Мысалы, ыстық денені салқын денемен жанастырсақ, онда жылу әрқашанда ыстық денеден салқын денеге өтеді. керісінше ешуақытта да болмайды. Егер де жылу салқын денеден ыстық де-неге өткен жағдайда да энергия сақталған болар еді, бірақ мұндай процесс тіптен мүмкін емес. Енді лақтырылған тасты қарастырайық. Ол Жер бетіне құлап түседі. Тас түсіп келе жатқан кезде оның бастапқыдағы потенциалдық энергиясы бірте-бірте кинетикалық энергияға айналып отырады. Ал тас Жер бетІне жеткен кезде, оның кинетикалық энергиясы тас пен Жердің ішкі энер-гиясына айналады (бұл дегеніміз осы денелердің молекулалары жеделірек қозғала бастайды, ал олардың температурасы сәл-пәл көтеріледі дегенді білдіреді). Бірақ ешкім күнІ бүгінге дейін тастыд молекулаларының жылулық қозғалысы энергиясының оның кинетикалық энергиясына айналуының арқасында қайтадан көкке котерілгенін коре алған емес. Мүндай процесс кезінде де энергия сақталар еді, бірақ процесс табиғатта кездеспейді. Табиғатта бола алатын, бірақ оларға кері процесстер таоиғатта мүмкін болмайтын басқа да талай мысалдарды келтіруге болады.
Келтірілген мысалдардағы кері процестер дс отетін болса, олар энергия-ның сақталу заңына ешқандай залал келтіре алмас едІ, энергияның сақталу заңы орындалған болар еді, яғни термодинамиканың бірінші бастамасы орын-далар сді.Процестердің қайтымсыздығын түсіндіру үшін ғалымдар откен ғасырдың екінші жартысында термодинамиканың екінші бастамасы деп аталатын жаңа заңды түжырымдады. Бұл заң бойынша табиғатта қандай процестердің мүмкін, ал қандай процестердің мүмкін болмайтындығын айтып беруге болады. Термодинамиканың екінші бастамасын бірнеше түрде түжырымдауға болады, олардың барлығы да өзара эквивалентті, тең баламалы. Ондай тұжырымдамалардың біреуін Р.Клаузиус берді: табиғи жағдайларда жылу ыстық денеден салқын денеге өтеді, ал салқын денеден ыстық денеге жылу өз бетімен берілмейді. Бүл айтылған тоқтам тек белгілі түрдегі процеске ғана жататын болғандыктан, оны басқа түрдегі процестерге қалай қолдану керек екендігі түсініксіз.Басқа түрдегі процестерді де қамти алатын жалпыламырақ тұжырымдама кажет болды.
Пайдалы әсер коэффициенті (ПӘК) – жүйенің (механизмнің) энергияны түрлендіру немесе басқа денеге беру тиімділігін сипаттайтын шама. Ол көбінесе грек әрпі η -мен (этта) белгіленіп, мына өрнек арқылы анықталады:η=A/Q=Q1*Q2/Q
Термодинамиканың екінші заңына сәйкес жылу қозғалтқыштарының Пайдалы әсер коэффициенттерінің Полужирное начертание ең жоғарғы мәні Карно циклі бойынша анықталады. Машиналардың (әр түрлі қондырғылардың) Пайдалы әсер коэффициенті олардың әрбір элементтерінің жылулық, механикалық т.б. Пайдалы әсер коэффициенттері мен оның экономиялық, техникалық, т.б. Пайдалы әсер коэффициенттеріне ажыратылады. Жүйенің (механизмнің) толық Пайдалы әсер коэффициенті оның дербес элементтерінің Пайдалы әсер коэффициентінің көбейтіндісіне тең:
η = (An+1)/A1 = η1ˑ η2 ˑ...ˑ ηn = ηi
“ Пайдалы әсер коэффициенті ” ұғымы өзінің жалпылама қасиетіне байланысты әр түрлі қондырғыларды (атомдық реакторлар, электр генераторлары, жылу қозғалтқыштары, жартылай өткізгіш құрылғылар, биологиялық объектілер, т.б.) қуаты мен тиімділігіне қарай бір-бірімен салыстыруға мүмкіндік береді.
32.Тасымал құбылыстары. Жылу өткізгіштік.
Тасымалдау Құбылыстары – физикалық жүйеде электр заряды, масса, импульс, энергия, энтропияның, т.б. физикалық шамалардың кеңістікте тасымалдануы (бөлінуі) арқылы өтетін кинетикалық процестер. Бұл бөлінулер заттың тұтас жүйе ретінде “таза” мех. қозғалысымен де, эл.-магн. күштердің әсерінен де және заттың құрамындағы микробөлшектердің (газ және сұйықтың молекулалары, металл торының электрондары мен оң таңбалы иондары, электролиттің иондары, т.б.) жылулық қозғалысымен де байланысты болады. Жүйеге сыртқы электр өрісінің әсер етуі нәтижесінде, жүйе температурасының құрамының және жүйені құрайтын бөлшектердің (атом, молекула) орташа жылдамдығының кеңістіктік біртекті болмауы салдарынан да Тасымалдау Құбылыстары пайда болады. Физ. шамалардың тасымалдануы олардың градиентіне кері бағытта жүреді.Тасымалдау Құбылыстары жүйені тепе-теңдік күйге жақындатады. Тасымалдау Құбылыстарына электрөткізгіштік (сыртқы электр өрісінің әсерінен электр зарядтарының тасымалдануы және айқас процестер), диффузия (концентрация градиентіне байланысты жүйенің бір бөлігінен екінші бөлігіне массаның тасымалдануы), жылуөткізгіштік (темп-ра градиенті нәтижесінде жылу энергиясының жүйенің бір бөлігінен екіншісіне тасымалдануы), т.б. құбылыстар жатады. Айқас процестер кезінде бір шаманың градиенті басқа шаманың тасымалдануына әкеледі. Мыс., термодиффузия немесе Соре эффектісі – темп-ра градиенті масса ағынын тудырады; керісінше концентрация градиенті есебінен жылу ағыны пайда болады (Дюфур эффектісі). Сыртқы магнит өрісі әсер етпейтін изотроптық жүйелерде термоэлектрлік эффектілер деп аталатын айқас құбылыстар байқалады: екі тізбектеп қосылған әр түрлі өткізгіштердің түрлі темп-радағы түйіндерінде электр тогы жоқ кезде электр қозғаушы күштің (ЭҚК) пайда болуы (Зеебек эффектісі); Пельте эффектісі – тұрақты температурадағы әр түрлі екі өткізгіштің түйіндерінен электр тогы өткенде жылудың бөлінуі немесе жұтылуы; Томсон эффектісі – тогы бар өткізгішті бойлай темп-ра градиенті болғанда жылудың бөлінуі немесе жұтылуы. Сыртқы магнит өрісі әсер ететін изотроптық жүйелерде гальваномагниттік және термомагниттік эффектілер болып саналатын айқас құбылыстар байқалады. Бұл құбылыстар электр тогының әсерінен туындаса оларды гальваномагниттік, ал жылу ағыны есебінен пайда болса термомагниттік деп атайды. Тасымалдау Құбылыстарын кинетик. теория зерттейді.
Жылу өткізгіштік — дененің температура айырмасы бар нүктелері арасында бір нүктеден екінші нүктеге жылу энергиясын жеткізу қасиеті немесе,басқаша айтқанда дененің температурасы жоғары жақтан температурасы төмен жағына қарай жылу өткізу қабілеті. Жылулықтың таралу процессін жалпы алғанда және жылу өткізгіштік сондай-ақ, дененің температурасының таралуымен тығыз байланысты. Сондықтан, алдымен температуралық өріс және температура градиенті ұғымдарымен байланыстығын анықтау керек. Заттардың жылу жүргізгіштігі әр түрлі жэне өте көп санды факторларға байланысты. Газдар үшін, елеулі болып, температурасы мен қысымдары жатады. Мысалы, газ үшін, температураның көбеюінен, жылу жүргізгіштігі артады, ал өте қыздырылған бу үшін, сол сияқты артады, қысымы да, дәл солай артады; сұйықтар үшін, температураның артуынан біраз азаяды. Бұған, су қосылмайды, оның шамамен 120°С температура кезінде, жылу жүргізгіштігі максимумда болады, ал одан ары температурасын көбейткен сайын, судың X кемиді. Көп металлдар үшін, температура ұлғайған сайын, X кемиді. құрылыс материалдары үшін, кеуектілігі мен ылғалдығы ерекше шамасында болады. Кеуектілігі көбейген сайын, X азаяды, себебі материалдардың кеуегі газбен толып, аз жылу өткізгішті болады.
33.Нақты (реал) газдар. Ван-дер-Ваальс теңдеуі.
Нақты газдар-Бойл-Мариот және Гей-Люссак заңдарына бағынбайтын газдар. Газдардың мінсіз жағдайдан ауытқу мөлшері олардың тығыздығы артқан сайын (қысым жоғары, температура төмен) өсе түседі, яғни газ тамшылары неғұрлым бір-біріне жақын орналасқан сайын, олардың бір-біріне әсері солғұрлым күшейе түседі.Газдың тығыздығы артқан сайын оның қасиеттері идеал газ күйінен ауытқи бастайды. Бұл жағдайда соқтығысулардың рөлі артып, молекулалардың мөлшерлері мен олардың өзара әсерлерін ескермеуге болмай қалады. Мұндай газды нақты (реал) газ деп атайды. Газ алмасу, биологияда – организм мен оны қоршаған орта арасындағы газ алмасу процесі. Адам мен жануарлар организмі тыныс алу кезінде сыртқы ортадан оттекті сіңіріп, өзінен көмі қышқыл газын және зат алмасу нәтижесінде пайда болатын әр түрлі газ қоспаларын сыртқа шығарады. Газ алмасусыз тірі организмде зат және энергия алмасуы дұрыс жүрмейді.
Нақты газдар өзгерісі; pV=mRT/μ
Нақты газдардың өзгерісін сипаттауға ұсынылған көптеген теңдеулердін ішінен Ван-дер-Ваальс теңдеу ең қарапайым,жақсы нәтиже беретін теңдеу болып табылады.
Молекулалардың молшерлері де, молекулалар арарсындағы өзараәрекет-тесу күштері де ескерілген жаңартылған күй теңдеуін 1873 жылы Ван-дер-Ваальс үсынды және ол қазір оның есімімен аталады.Нақты газдардың күй теңдеуі жуықталған тендеу, себебі молекулалардың арасындағы озара өрекеттесу күштерін дәл есептеу әлі де мүмкін болмай отыр. Идеал газдың бір молі үшін жазылған; ρV=RT
Күй теңдеуінде V деп газ түрған ыдыстың колемін түсшеміз. Екінші жағынан онда қозғалып жүрген газ молекулаларынын, кезкелгенінің кезкелген жерде бола алатын көлемі, себебі идеал газдьтң материалдық нүкте-молекулалары үшін ыдыстың кезкелген жері бос, әр молекула үшін ыдыста одан басқа мо-лекула жоқ тәрізді. Шындығында газда ыдыстың барлық көлемі молекулалар үшін бос емсс, себебі әр молекула белгілі келем алып түр және ыдыстың бүл болігінде басқа молекулалар бола алмайды.Бүл жағдайды ескеру үшін ыдыстың көлемінен молекулалар қозғала ал-майтын, олардың оздері алып түрған колемін алып тастау керек.Сонда: ρ(V-b)=RT
мүндағы V-түзету газдың қысымды шексіз арттырған кезде (газ молекулала-рын әбден тығыздаған кезде) алатын шектік көлемі:
V-b=RT/ρ
Ыдыстың қабырғасына жуық орналасқан кез келген молекуланың бір жағындагы "көршілері" екінші жағындағы "көршілерінен" артық, болады да, оған түсірілетін басқа молекулалар тарапынан пайда болатын қорытқы тартылыс күші басы артық молекулалар саны бар жағына қарай, яғни ыдыстың ішіне қарай бағытталады. Осының арқасында ыдыстың қабырғасына түсірілетін кысым қайсыбір шамасына кем болады. Сөйтіп, қысым үшін:
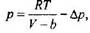

Газдың қысымы үшін өрнекті молекулалар арасындағы тартылыс күшін ескере отырып, былайша жазуға болады:
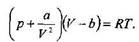
Осыдан,газдың қысымын, колемін және температурасын байланыстыратын бүл теңдеу нақты газдың күй теңдеуі болып табылады;

Мұнда m— газдың массасы, М- оның молдік массасы, V— газдың алып түрған көлемі.
34. Клайперон-Клаузиус теңдеуі. Күй диаграммасы. Үштік нүкте.
Клапейрон - Клаузиус теңдеуі – заттың бір фазадан басқа бір фазаға (булану, балқу, сублимация, т.б.) ауысу процесін сипаттайтын термодинамикалық теңдеу. Клапейрон - Клаузиус теңдеуі бойынша тепе-тең күйде өтетін процестегі L фазалық ауысу жылуы (мысалы, булану жылуы, балқу жылуы) мына өрнек бойынша анықталады:
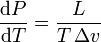
, мұндағы T – ауысу температурасы (изотермиялық процесс), dp/dT – фазалық тепе-теңдік қисық сызығындағы қысымның температура бойынша алынған туындысы, 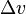 – 1-фазадан 2-фазаға ауысу кезіндегі зат көлемінің өзгерісі. Клапейрон - Клаузиус теңдеуі француз оқымыстысы Б.П. Э.Клапейрон (1799 – 1864) сұйықтық пен жылулық тепе-теңдікте тұрған конденсацияланған буға арналған Карно циклін талдау нәтижесінде алды (1834). 1850 ж. неміс физигі Р.Клаузиус (1822 – 1888) теңдеуді одан әрі жетілдіріп, оны басқа да фазалық ауысуларға арнап, қорытындылады. Бұл теңдеуді жылуды жұту немесе шығару арқылы өтетін кез келген фазалық ауысуларға қолдануға болады. Клапейрон - Клаузиус теңдеуін шешу үшін L, V1 және V2 шамаларының температура мен қысымға байланысты қалай өзгеретіндігін білу қажет. Мұның өзі күрделі мәселе. Әдетте, бұл тәуелділік тәжірибе жүзінде анықталып, Клапейрон - Клаузиус теңдеуінің сан мәні есептеледі. Клапейрон - Клаузиус теңдеуі таза заттармен қатар ерітінділерге және олардың жеке құраушыларына да қолданылады. Соңғы жағдайда Клапейрон - Клаузиус теңдеуін берілген құраушыдағы будың парциал қысымын, оның парциал булану жылуымен байланыстырады
– 1-фазадан 2-фазаға ауысу кезіндегі зат көлемінің өзгерісі. Клапейрон - Клаузиус теңдеуі француз оқымыстысы Б.П. Э.Клапейрон (1799 – 1864) сұйықтық пен жылулық тепе-теңдікте тұрған конденсацияланған буға арналған Карно циклін талдау нәтижесінде алды (1834). 1850 ж. неміс физигі Р.Клаузиус (1822 – 1888) теңдеуді одан әрі жетілдіріп, оны басқа да фазалық ауысуларға арнап, қорытындылады. Бұл теңдеуді жылуды жұту немесе шығару арқылы өтетін кез келген фазалық ауысуларға қолдануға болады. Клапейрон - Клаузиус теңдеуін шешу үшін L, V1 және V2 шамаларының температура мен қысымға байланысты қалай өзгеретіндігін білу қажет. Мұның өзі күрделі мәселе. Әдетте, бұл тәуелділік тәжірибе жүзінде анықталып, Клапейрон - Клаузиус теңдеуінің сан мәні есептеледі. Клапейрон - Клаузиус теңдеуі таза заттармен қатар ерітінділерге және олардың жеке құраушыларына да қолданылады. Соңғы жағдайда Клапейрон - Клаузиус теңдеуін берілген құраушыдағы будың парциал қысымын, оның парциал булану жылуымен байланыстырады
Үштік нүкте, термодинамикада — заттың үш фазасының да бірдей бір мезгілдегі тепе-теңдік күйіне сәйкес келетін күй диаграммасындағынүкте. Фазалар ережесі бойынша жеке химиялық зат (бір құраушылы жүйе), тепе-теңдік кезінде, үш фазадан артық күйде бола алмайды. Бұл үш фазаның (қатты, сұйық және газ) бір мезгілде тепе-теңдікте болуы температура (Т) мен қысымның (р) белгілі бір мәндерінде ғана жүзеге асады. Мысалы, көмір қышқыл газы (СО2) үшін Тү.н.T 216,6 К, рү.н.р 5,12 атм, су үшін Тү.н.Т 273,16 К (дәл), рү.н.4,58 мм сын. бағ.
Date: 2016-07-22; view: 4834; Нарушение авторских прав