
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Характерные реакции катионов III аналитической группы по кислотно-основной классификации.
|
|
Аналитические реакции катионов третьей аналитической группы по кислотно-основной классификации: Ca2+,Sr2+,Ba2+
При действии группового реагента (водного раствора серной кислоты ^SO.j) катионы третьей аналитической группы осаждаются в виде малорастворимых в воде сульфатов кальция CaSO4,стронцияSrSO4 и бария BaSO4 (свинец осаждается в виде сульфата PbSO4). Числовые значения произведений растворимости этих сульфатов при комнатной температуре равны: Ks°(CaSO4) = 2,5 10-5,Ks° (SrSO4) = 3,2 10-7, Ks°(BaSO4) = 1,110-10,Ks°(PbSO4) = 1,6 10-8. При действии группового реагента катионы кальция неполностью осаждаются из водного рас-творавформеосадкасульфата кальция - частьионов Ca2+ остается в растворе. Для более полного осаждения катионов кальция в форме сульфата кальция при действии группового реагента к анализируемому раствору прибавляют этанол, в присутствии которого растворимость сульфата кальция уменьшается.
Сульфаты кальция, стронция и бария практически нерастворимы в разбавленных кислотах, щелочах. Сульфат бария заметно растворяется в концентрированной серной кислоте с образованием кислой соли Ba(HSO4)2 Сульфат кальция растворим в водном растворе сульфата аммония (NH4)2SO4 с образованием комплекса (NH4)2[Ca(SO4)2]; сульфаты стронция и бария - не растворяются.
Аналитические реакции катиона кальция Ca2+
Реакция с сульфат-ионами. Катионы кальция образуют с сульфат-ионами SO2" белый осадок малорастворимого в воде сульфата кальция, который при медленной кристаллизации выделяется в форме игольчатых кристаллов гипса - дигидрата сульфата кальция-CaSO42H2O: 
Для увеличения полноты осаждения к раствору прибавляют равный объем этанола - в водно-этанольной среде растворимость сульфата кальция уменьшается по сравнению с растворимостью в чистой воде.
Осадок сульфата кальция нерастворим в кислотах и щелочах, но растворяется в насыщенном водном растворе сульфата аммония с образованием комплекса (NH4)2[Ca(SO4)2]: 
что позволяет отделить катионы Ca2+ от катионов Sr2+ иBa2+.
При нагревании с растворимыми карбонатами, например, с раствором соды Na2CO3, белый осадок сульфата кальция переходит в белый же осадок карбоната кальция:
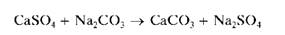
Карбонат кальция растворим в кислотах, поэтому нагревание CaSO4 с раствором соды с последующим растворением образующегося CaCO3 используют для отделения катионов кальция (вместе с катионами стронция и бария) от других катионов и перевода их в раствор.
Реакцию катионов кальция с сульфат-ионами обычно проводят как микрокристаллоскопическую. Предельное разбавление равно 2,5-104 мл/г.
Методика. Каплю раствора хлорида кальция CaCl2 наносят на предметное стекло, прибавляют каплю раствора серной кислоты и слегка упаривают смесь. Под микроскопом наблюдают образовавшиеся игольчатые кристаллы гипса CaSO4•2H2Oв виде красивых сросшихся пучков или звездочек.
Реакция с оксалатом аммония (фармакопейная). Катионы Ca2+ образуют с оксалатом аммония (NH4)2C2O4 белый кристаллический осадок оксалата кальция CaC2O4:

Реакцию проводят в слабокислой среде (рН «6-6,5) в присутствии уксусной кислоты, в которой оксалат кальция не растворяется. В конце проведения реакции можно добавить аммиак.
Осадок CaC2O4 нерастворим в растворе аммиака, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты H2C2O4, например:
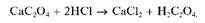
Открываемый минимум - около 100 мкг, предельное разбавление - 6 104 мл/г (подругимданным~3 • 105 мл/г).
Мешают катионы Sr2+,Ba2+,Mg2+, дающие аналогичные осадки.
Методика. В пробирку вносят 3 капли раствора CaCl2, прибавляют каплю раствора уксусной кислоты и 3 капли раствора оксалата аммония. Выпадает белый кристаллический осадок оксалата кальция.
Реакция с гексацианоферратом(П) калия. Катионы Ca2+ образуют с гексацианоферратом(П) калия K4[Fe(CN)6] при нагревании раствора до кипения в присутствии катионов аммония белый кристалличе-
ский осадок смешанного гексацианоферрата(П) аммония и кальция 
Осадок нерастворим в уксусной кислоте.
Открываемый минимум равен 25 мкг, предельное разбавление - 2-103 мл/г.
Мешают катионы Ba2+ и другие катионы, образующие осадки фер-роцианидов.
Методика. В пробирку вносят 3-4 капли насыщенного водного раствора CaCl2, 2-3 капли раствора аммиака. Нагревают раствор до кипения и прибавляют 5-6 капель свежеприготовленного насыщенного раствора K4[Fe(CN)6]. Выпадает белый кристаллический осадок.
Реакция сродизонатом натрия. Катионы Ca2+ образуют со свежеприготовленным раствором родизоната натрия Na2C6O6 вщелочнойсреде осадок фиолетового комплекса, состав которого, по-видимому, можно описать формулой Ca2C6O6(OH)2: 
Реакция довольно чувствительна: предел обнаружения - 1 мкг, предельное разбавление - 5-104 мл/г. Катионы Sr2+ иBa2+не мешают, так как в щелочной среде не образуют осадки с родизонатом натрия.
Реакцию можно проводить капельным методом на фильтровальной бумаге.
Методика. В пробирку вносят 3-4 капли раствора CaCl2,3-4 капли раствора NaOH и ~2 капли свежеприготовленного 0,2 % раствора ро-дизоната натрия. Выпадает фиолетовый осадок.
При проведении реакции на фильтровальной бумаге поступают следующим образом. На лист фильтровальной бумаги наносят каплю щелочного раствора CaCl2 и каплю свежеприготовленного 0,2 % раствора Na2C6O6 Образуется пятно (или осадок) фиолетового цвета.
Окрашивание пламени газовой горелки (фармакопейный тест). Соли (или другие соединения) кальция окрашивают пламя газовой горелки в кирпично-красный цвет.
Методика. На кончике платиновой или нихромовой проволоки, смоченной раствором HCl, вносят в пламя газовой горелки несколько кристалликов соли кальция или каплю раствора CaCl2 Пламя окрашивается в кирпично-красный цвет.
Другие реакции катионов кальция. Катионы Ca2+ образуют также осадки при реакциях в растворах: с растворимыми карбонатами - белый осадок CaCO3 (растворяется в кислотах), с гидрофосфатом натрия
Na2HPO4 - белый CaHPO4 (растворяется в кислотах), с хроматами - желтый CaCrO4, с фторидами - белый студенистый CaF2 (малорастворимый в кислотах и разлагающийся при нагревании с концентрированной серной кислотой).
Аналитические реакции катиона стронция Sr2+
Реакция с сульфат-ионами. Катионы Sr2+ образуют с сульфат-ионами белый осадок сульфата стронция SrSO4: 
Осадок нерастворим в щелочах, в растворе сульфата аммония (NH4)2SO4 (в отличие от сульфата кальция, который растворяется в этом реагенте).
Осадок сульфата стронция образуется и при прибавлении «гипсовой воды» (насыщенный водный раствор сульфата кальция) к растворам, содержащим соли стронция, поскольку растворимость в воде сульфата стронция ниже растворимости сульфата кальция. Добавление «гипсовой воды» приводит к образованию осадка SrSO4 лишь при нагревании; без нагревания осадок SrSO4 выделяется только при длительном стоянии. Мешают катионы Ba2+.
При нагревании осадка SrSO4 с раствором соды он, как и сульфат кальция, переходит в карбонат стронция SrCO3, также нерастворимый в кислотах.
Методика.
а) Реакция с «гипсовой водой». В пробирку вносят 4 капли раствора хлорида стронция SrCl2, прибавляют 5-6 капель «гипсовой воды», нагревают на водяной бане и оставляют на ~10-15 минут. Постепенно выделяется белый осадок сульфата стронция.
б) Реакция с серной кислотой. В пробирку вносят 1-2 капли раствора SrCl2, прибавляют 2-3 капли раствора серной кислоты. Выпадает белый кристаллический осадок сульфата стронция.
Реакция с карбонат-ионами. Катионы Sr2+ образуют при нагревании с карбонат-ионами CO32-белый кристаллический осадок карбоната стронция: 
Осадок растворяется в кислотах.
Методика. В пробирку вносят 3-5 капель раствора SrCl2,прибавля-ют столько же капель раствора карбоната аммония (NH4)2CO3 иосто-рожно нагревают пробирку с раствором. Выпадает белый осадок карбоната стронция.
Реакция с родизонатом натрия. Катионы Sr2+ образуют с родизона-том натрия Na2C6O6 в нейтральной среде бурый осадок родизоната стронция, по-видимому, состава SrC6O6: 
Реакцию проводят капельным методом на фильтровальной бумаге. Предел обнаружения - 7 мкг.
Катионы бария также образуют бурый осадок с родизонатом натрия. Однако родизонат стронция, в отличие от родизоната бария, растворим в хлороводородной кислоте, тогда как родизонат бария при взаимодействии с HO превращается в ярко-красный гидрородизонат бария.
Методика. На лист фильтровальной бумаги наносят каплю раствора SrCl2 и каплю свежеприготовленного 0,2 % раствора родизоната натрия. Наблюдается образование красно-бурого пятна.
На пятно наносят каплю раствора HO. Окраска пятна исчезает (в присутствии катионов бария окраска не исчезает, а переходит из бурой в ярко-красную).
Окрашивание пламени газовой горелки. Соли (и другие соединения) стронция при внесении в бесцветное пламя газовой горелки окрашивают пламя в карминово-красный цвет. Методика аналогична описанной выше для теста на другие катионы.
Другие реакции катионов стронция. Катионы Sr2+ образуют также осадки при реакциях в растворах: c оксалатом аммония (NH4)2C2O4 - белый SrC2O4 (частично растворяется в уксусной кислоте), с гидрофосфатом натрия Na2HPO4 - белый SrHPO4 (растворяется в кислотах), с хроматом калия K2CrO4 - желтый SrCrO4 (растворяется в уксусной кислоте; реакция высокочувствительна: предел обнаружения - 0,8 мкг).
Применяют также довольно чувствительную (предельное разбавление - 104 мл/г) микрокристаллоскопическую реакцию образования сине-зеленых кубических кристаллов K2Sr[Cu(NO2)6].
Аналитические реакции катионов бария Ba2+
Date: 2016-07-18; view: 2933; Нарушение авторских прав