
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Характерные реакции катионов I аналитической группы по кислотно-основной классификации.
|
|
Аналитические реакции катионов первой аналитической группы по кислотно-основной классификации: Li+,Na+,K+, NH 4
Групповой реагент отсутствует.
При проведении реакций обращают внимание:
1) на наблюдаемый эффект: выпадение осадка, его цвет, характер, выделение газа, окрашивание раствора;
2) на условия проведения реакции: кислотность среды, нагревание, добавление органического реагента и т.д.;
3) на свойства выделяющихся осадков: растворимость их в растворах кислот, щелочей и т.д.;
4) на мешающие катионы в условиях обнаружения;
5) на чувствительность реакций.
Аналитические реакции катиона лития Li+
Реакция с двузамещенным гидрофосфатом натрия Na2HPO4 Гидрофосфат натрия Na2HPO4 в нейтральной или слабощелочной среде образует с катионами лития белый осадок фосфата (ортофосфата) лития
Li3PO4: 3Li+ + HPO2- <=* Li3PO4 + H+
Для увеличения полноты осаждения при проведении реакции добавляют этанол, поскольку в водно-этанольной среде растворимость фосфата лития уменьшается. Фосфат лития растворим в растворах кислот и солей аммония. Реакцию проводят обычно в аммиачной среде для связывания выделяющихся ионов водорода. Предел обнаружения катионов лития данной реакцией составляет 5 мкг. Мешают все катионы, образующие нерастворимые (малорастворимые) в воде фосфаты.
Методика. В пробирку вносят ~10 капель раствора соли лития, прибавляют столько же капель концентрированного раствора аммиака, несколько капель этанола и ~15 капель раствора гидрофосфата натрия. Через ~5 минут выпадает белый мелкокристаллический осадок, растворимый в уксусной кислоте. Большое количество этанола не следует прибавлять во избежание выделения осадка Na2HPO4.
Реакция с растворимыми карбонатами. Карбонат-ионы CO2,- осаждают из водных нейтральных, щелочных (но не кислых!) растворов солей лития белый осадок карбоната лития Li2CO3:
2Li+ + CO2 = Li2CO3
Карбонат лития заметно растворим в воде, вследствие чего катионы лития осаждаются из раствора неполностью. Поэтому для проведения реакции используют концентрированные растворы солей лития и растворимых карбонатов. Реакцию предпочтительно проводить при нагревании, так как растворимость карбоната лития в воде уменьшается с ростом температуры. Карбонат лития растворяется в кислотах. Предел обнаружения ~500 мкг. Мешают все катионы, образующие малорастворимые в воде карбонаты.
Методика. В пробирку вносят несколько капель концентрированного раствора соли лития, прибавляют примерно столько же концентрированного раствора соды Na2CO3 (или поташа K2CO3) и нагревают смесь. Выпадает белый мелкокристаллический осадок карбоната лития Li2CO3.
Реакция с растворимыми фторидами. Фторид-ионы досаждают из водных растворов солей лития белый осадок малорастворимого в воде фторида лития LiF:

Растворимость фторида лития в воде уменьшается в присутствии аммиака. Предел обнаружения - 50 мкг. Мешают катионы Mg2+,Ca2+, Sr2+,Ba2+,Cu2+,Pb2+, также дающие осадки фторидов.
Методика. В пробирку вносят 3-4 капли раствора соли лития, 1- 2 капли концентрированного аммиака и 4-5 капель раствора фторида аммония NH4F. Смесь нагревают. Медленно выпадает аморфный осадок фторида лития. Осадок растворяется в уксусной кислоте.
Окрашивание пламени газовой горелки. Соли лития окрашивают пламя газовой горелки в карминово-красный цвет.
Методика. На платиновой или нихромовой проволочке (или на кончике графитового стержня) вносят в пламя газовой горелки несколько кристалликов хлорида лития LiCl. Пламя окрашивается в карми-ново-красный цвет. Если пламя окрашивается в желтый цвет из-за присутствия следов катионов натрия, то его рассматривают через синее стекло или индиговую призму - склянку специальной призматической формы, заполненную раствором красителя - индиго (синее стекло и раствор индиго поглощают желтые лучи).
Некоторые другие реакции катионов лития. Катионы лития образуют со стеаратом аммония CH3(CH2)16COONH4малорастворимый осадок стеарата лития CH3(CH2)16COOLi, c цинкуранилацета-том Zn(UO2)3(CH3COO)8 - желто-зеленый осадок LiZn(UO2)3 (CH3COO)99H2O, с гексагидроксостибатом калия K[Sb(OH)6] -
белый осадок Li[Sb(OH)6], с гексанитрокобальтатом(Ш) натрия Na3[Co(NO2)6] - желтый осадок Li3[Co(NO2)6].
Аналитические реакции катиона натрия Na+
Известно ограниченное число аналитических реакций катиона натрия.
Микрокристаллоскопическая реакция с цинкуранилацетатом (фармакопейная). Катионы натрия дают с цинкуранилацетатом Zn(UO2)3 (CH3COO)8 в уксуснокислом растворе желтый кристаллический осадок натрийцинкуранилацетата NaZn(UO2)3(CH3COO)99H2O, нерастворимый в уксусной кислоте:

Натрийцинкуранилацетат образует кристаллы октаэдрической и тетраэдрической формы, хорошо различимые при рассмотрении под микроскопом в капле раствора. Предел обнаружения - около 0,8 мкг; реакция высокочувствительна. Мешают катионы Li+,K+, NH J,Mg2+, Ca2+,Sr2+,Ba2+,Cu2+,Zn2+,Cd2+,Hg2+,Al3+,Mn2+,Co2+,Ni2+ при их содержании более 5 мг в1 мл раствора.
Методика. На предметное стекло наносят каплю раствора NaCl, слегка упаривают до начала образования белой каемки по краям капли и прибавляют каплю раствора цинкуранилацетата. Через 2-3 мин наблюдают под микроскопом образование желтых октаэдрических и тет-раэдрических кристаллов.
Микрокристаллоскопическая реакция с гексагидроксостибатом(У) калия. Катионы натрия образуют с гексагидроксостибатом(У) калия K[Sb(OH)6] в нейтральном (рН «7) растворе белый мелкокристаллический осадок гексагидроксостибата(У) натрия Na[Sb(OH)6]:

Из разбавленных растворов осадок выпадает медленно или вообще не выпадает. В сильно щелочной среде осадок не образуется, а из сильно кислых растворов выделяется белый аморфный осадок метасурьмя-ной кислоты HSbO3, который можно ошибочно принять за осадок гек-сагидроксостибата натрия. Поэтому образование белого осадка само по себе еще недостаточно для вывода о присутствии катионов натрия; необходимо при рассмотрении под микроскопом убедиться в том, что этот осадок - кристаллический. Реакцию проводят на холоду.
В присутствии нитрат-ионов выделение осадка замедляется.
Реакция малочувствительна и удается лишь при больших концентрациях катионов натрия. Мешают катионы лития, аммония, магния.
Методика. На предметное стекло наносят каплю концентрированного раствора NaCl и одну каплю раствора гексагидроксостибата(У) калия. Через 3-5 минут наблюдают под микроскопом образование кристаллов.
Окрашивание пламени газовой горелки соединениями натрия (фармакопейный тест). Соли и другие соединения натрия окрашивают пламя газовой горелки в желтый цвет. Реакция высокочувствительна. Открываемый минимум составляет 110-4 мкг.
Методика. На кончике графитового стержня (или на нихромовой либо платиновой проволочке) вносят в пламя газовой горелки несколько кристалликов соли натрия (например, NaCl). Пламя окрашивается в ярко-желтый цвет. Окраска не исчезает в течение нескольких секунд.
Аналитические реакции катиона калия K+
Наиболее часто катионы калия открывают реакциями с гексанитро-кобальтатом(Ш) натрия Na3[Co(NO2)6], с гексанитрокупратом(П) натрия и свинца Na2Pb[Cu(NO2)6], с гидротартратом натрия NaHC4H4O6 и по фиолетовому окрашиванию пламени газовой горелки.
Катионы аммония NH4, как правило, мешают открытию катионов калия, поэтому перед открытием катионов калия их необходимо предварительно удалить, если они присутствуют в анализируемом растворе.
Реакция с гексанитрокобальтатом(Ш) натрия (фармакопейная). Катионы калия в достаточно концентрированных растворах в уксуснокислой (рН «3) или нейтральной среде образуют с растворимым в воде Na3[Co(NO2)6] желтый кристаллический осадок гексанитрокобаль-тата(Ш) натрия и калия NaK2[Co(NO2)6]:

Из разбавленных растворов осадок выпадает медленно, при стоянии раствора. В сильно кислой среде образуется нестойкая, быстро разлагающаяся кислота H3[Co(NO2)6]. В щелочной среде выпадает бурый осадок гидроксида кобальта(Ш) Co(OH)3.
Для проведения реакции используют свежеприготовленный водный раствор Na3[Co(NO2)6], так как со временем этот реагент разлагается. Потирание стеклянной палочкой стенок пробирки ускоряет формирование осадка (NaK2[Co(NO2)6] склонен к образованию пересыщенных
растворов). В присутствии катионов серебра Ag+ выпадает еще менее растворимый осадок состава K2Ag[Co(NO2)6], поэтому наличие катионов серебра в растворе повышает чувствительность реакции.
Предел обнаружения - 4 мкг; предельное разбавление - 13-103 мл/г. Мешают катионы Li+, NH 4, также образующие желтые осадки.
Методика. В пробирку вносят 2 капли концентрированного раствора соли калия и 2 капли свежеприготовленного концентрированного раствора Na3[Co(NO2)6]. Выпадает желтый осадок NaK2[Co(NO2)6]. Если осадок не образуется, то потирают стенки пробирки стеклянной палочкой.
Микрокристаллоскопическая реакция с гексанитрокупратом(П) натрия и свинца. Катионы калия в нейтральной среде образуют с гекса-нитрокупратом(П) натрия и свинца Na2Pb[Cu(NO2)6] черные кристаллы гексанитрокупрата(П) калия и свинца K2Pb[Cu(NO2)6]кубической формы, хорошо видимые под микроскопом:
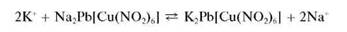
Реакция высокочувствительна: открываемый минимум - 0,15 мкг, предельное разбавление - 6,6-103 мл/г. Мешают катионы NH J,Rb+, Cs+, также дающие черный осадок с реактивом.
Методика. На предметное стекло наносят каплю раствора соли калия, осторожно упаривают над пламенем газовой горелки до образования белой каемки по краям капли, охлаждают до комнатной температуры и прибавляют каплю раствора Na2Pb[Cu(NO2)6]. Через 1-2 мин наблюдают под микроскопом образование в жидкости черных кубических кристаллов.
Реакция с гидротартратом натрия (фармакопейная). Катионы калия при реакции с гидротартратом натрия NaHC4H4O6(или с винной кислотой H2C4H4O6 в присутствии ацетата натрия CH3COONa) в нейтральной среде образуют малорастворимый в воде гидротартрат калия KHC4H4O6, выпадающий в виде белого кристаллического осадка:
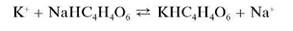
Образование осадка ускоряется при потирании стенок пробирки стеклянной палочкой.
Осадок растворяется в кислотах с образованием винной кислоты и в щелочах - с образованием средних тартратов, например, среднего тартрата калия K2C4H4O6.
Предел обнаружения - около 50 мкг, предельное разбавление ~103 мл/г. Мешают катионы NH44, образующие осадок состава NH4HC4H4O6, а также катионы Rb,Cs+.
Реакцию можно проводить микрокристаллоскопически. Методика. В пробирку вносят 2-3 капли раствора соли калия, 2 капли раствора гидротартрата натрия и потирают стенки пробирки стеклянной палочкой. Через некоторое время образуется белый кристаллический осадок.
Окрашивание пламени газовой горелки (фармакопейный тест). Соли и другие соединения калия при внесении их в пламя газовой горелки окрашивают его в фиолетовый цвет.
Методика. На кончике графитового стержня (или нихромовой либо платиновой проволочки) вносят в пламя газовой горелки кристаллики хлорида калия (или другой соли калия). Наблюдается окрашивание пламени в фиолетовый цвет.
Другие аналитические реакции катионов калия. С гексахлороплатинатом(IV) натрия Na2[PtCl6] и соответствующей кислотой H2[PtCl6] катионы калия образуют желтый кристаллический осадок гексахлороплатината(IV) калия K2[PtCl6]: 
Предел обнаружения - около 25 мкг. Мешают катионы NH44, также дающие желтый осадок гексахлороплатината аммония (NH4)2[PtCl6].
С хлорной кислотой HClO4 катионы K+ выделяют белый кристаллический осадок перхлората калия KClO4: 
С кремнефтороводородной кислотой H2SiF6 в нейтральной среде катионы K+ образуют студенистый осадок гексафторосиликата калия
K2SiF6: 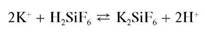
Катионы аммония не мешают этой реакции.
Аналитические реакции катиона аммония NII4
Реакция разложения солей аммония щелочами (фармакопейная). Соли аммония в растворах щелочей разлагаются с выделением газообразного аммиака: 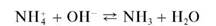
Выделяющийся газообразный аммиак обнаруживают с помощью влажной красной лакмусовой бумаги (синеет в парах аммиака), влажной фенолфталеиновой бумаги (в парах аммиака окрашивается в малиновый цвет) или стеклянной палочки, кончик которой смочен концентрированной хлороводородной кислотой - в парах аммиака наблюдается образование белого дыма хлорида аммония: 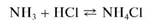
Реакция специфична и высокочувствительна.
Методика. В пробирку вносят 8-10 капель раствора соли аммония, прибавляют такой же объем раствора NaOH и осторожно нагревают раствор, не допуская его кипения и разбрызгивания. Над раствором помещают влажную красную лакмусовую бумагу, не касаясь ею стенок пробирки во избежание попадания на бумагу капелек щелочного раствора. Выделяющиеся пары аммиака окрашивают красную лакмусовую бумагу в синий цвет.
Реакция с реактивом Несслера - смесью раствора тетрайодомерку-рата(П) калия K2[HgI4] c KOH (фармакопейная). Катионы аммония образуют с реактивом Несслера аморфный красно-бурый осадок. Чаще всего состав этого осадка описывают формулами
Реакция высокочувствительна: предел обнаружения - 0,05-0,25 мкг, предельный объем ~0,05 мл. Позволяет открывать следы катионов аммония - наблюдается окрашивание раствора в желтый или бурый цвет. Мешают все катионы, дающие со щелочами окрашенные осадки (Cr3+,Fe3+,Co2+,Ni2+ и др.) или разлагающие реактив Несслера (Hg2+,Sn2+,Sb3+).
Методика. К 1-2 каплям раствора соли аммония прибавляют ~2 капли реактива Несслера. Выпадает аморфный красно-бурый осадок.
Другие аналитические реакции катионов аммония. Катионы аммония в растворе образуют с Na3[Co(NO2)6^H2[PtCl6] желтые осадки соответственно (NH4)2Na[Co(NO2)6] и (NH4)2[PtCl6]; с гидротартратом натрия NaHC4H4O6 - белый осадок гидротартрата аммония NH4HC4H4O6;cNa2Pb[Cu(NO2)6] - черный осадок, что может помешать открытию катионов калия. Катионы аммония мешают также открытию катионов натрия.
Перед открытием катионов натрия и калия удаляют катионы аммония, если они присутствуют в анализируемом растворе.
Date: 2016-07-18; view: 3820; Нарушение авторских прав