
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Жесткость природных вод и ее устранение
|
|
Мерой содержания в природных водах солей является жесткость воды. Природная вода, содержащая большое количество растворённых солей кальция, магния и железа, называется жёсткой. Различают общую, временную (карбонатную) и постоянную (некарбонатную) жёсткости.
Общей жёсткостью называется суммарная концентрация ионов Ca2+, Mg2+ и Fe2+ в воде, выраженная в ммоль экв/л. Общая жёсткость воды равна сумме постоянной и временной жёсткости.
Постоянной жёсткостью называется часть общей жёсткости, остающаяся после кипячения воды при атмосферном давлении в течение определённого времени. Постоянную жёсткость воды называют также некарбонатной жёсткостью, т.к. она обусловлена наличием сульфатов, хлоридов, силикатов кальция, магния и железа.
Временной жёсткостью называется часть общей жёсткости, удаляющаяся кипячением воды при атмосферном давлении в течение определённого времени. Она равна разности между общей и постоянной жёсткостью. Временную жёсткость также называют карбонатной жёсткостью, т.к. она обусловлена наличием гидрокарбонатов кальция и магния.
По величине жёсткости воду делят на 6 классов.
| Классы | Жёсткость воды (ммоль экв/л) |
| 1 (очень мягкая) 2 (мягкая) 3 (средней жёсткости) 4 (довольно жёсткая) 5 (жёсткая) 6 (очень жёсткая) | 0 – 1,5 1,5 – 3,0 3,0 – 4,5 4,5 – 6,0 6,0 – 10,0 свыше 10,0 |
Жёсткая водаоказывает вредное действие на технологические процессы и вызывает неприятные явления при использовании её в быту.
Обработка воды, приводящая к снижению жесткости воды, называется умягчением воды.
Существующие способы умягчения можно разделить на 3 группы:
q реагентные (химические) методы умягчения воды. Химическая обработка воды основана на переводе растворимых солей кальция и магния в труднорастворимыее соли; В качестве реагентов–осадителей применяют известь, соду, едкий натр, фосфаты натрия и др. Чаще применяется сода в смеси с известью или едким натром;
q умягчение воды методом ионного обмена (пропускание воды через ионообменные смолы);
q термическое умягчение воды (кипячение).
Для устранения временной жёсткости воды применяют:
– термическое умягчение (кипячение):

– реагентное умягчение гашёной известью:


Известь нейтрализует углекислоту, которая является одной из причин коррозии металлов, осаждает железо и способствует коагуляции коллоидов, например, кремниевой кислоты.
Для устранения общей жёсткости методом осаждения используют:
– карбонат натрия (соду):




– фосфат натрия (тринатрийфосфат):


В последнее время для очистки воды стали широко применять иониты (ионообменные смолы). Метод ионного обмена – катионирование основан на фильтровании через слой катионита, при котором происходит замещение ионов Ca2 и Mg2+, содержащихся в воде, на катионы Na+, K+ или NH+4, содержащиеся в твёрдой фазе катионита. В качестве катионитов в основном применяют иониты КУ-I и КУ-2.
В некоторых случаях требуется удалить из воды не только катионы Ca2+ и Mg2+, но и другие катионы и анионы. В таких случаях воду пропускают последовательно через катионит, содержащий в обменной форме водородные ионы (Н+-катионит) и анионит, содержащий гидроксильные ионы (ОН––анионит). В итоге вода освобождается как от катионов, так и от анионов солей. Такая обработка воды называется обессоливанием:

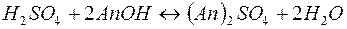
Обменная ёмкость  катионита определяется из соотношения:
катионита определяется из соотношения:
 (ммоль экв/г),
(ммоль экв/г),
где: V- объём воды, пропущенный через катионит, л;
m – масса катионита, г.
Общая жёсткость воды может быть рассчитана по формуле:
 (ммоль экв/л)
(ммоль экв/л)
где: m1, m2, m3 – массы содержащихся в воде катионов кальция, магния (или соответствующих им солей), мг;
Мэкв.1 , Мэкв.2 , Мэкв.3 – молярные массы эквивалентов металлов (или соответствующих им солей), г/моль экв;
V– объём воды, л.
Date: 2016-11-17; view: 427; Нарушение авторских прав