
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Примеры решения типовых задач.
|
|
Пример 1. Влияние концентрации реагента на скорость химической реакции.
Задача 1. Определите скорость реакции  по реагентам А и В, если при увеличении концентрации вещества А в 4 раза скорость реакции возрастает в 2 раза, а концентрации В в 4 раза – в 4 раза.
по реагентам А и В, если при увеличении концентрации вещества А в 4 раза скорость реакции возрастает в 2 раза, а концентрации В в 4 раза – в 4 раза.
Решение. Скорость реакции можно выразить уравнением
 (7)
(7)
В условии варьирования концентрации А концентрация В постоянна. Тогда уравнение (7) приобретает вид
 (8)
(8)
где  .
.
При увеличении [А] в 4 раза его новая концентрация составит 4[А]. Тогда скорость реакции для этих разных концентраций в соответствии с уравнение (8) выразится уравнениями:
 (9)
(9)
 (10)
(10)
Поделив почленно левые и правые части уравнений скорости (9) и (10), имеем
 .
.
Так как  , то
, то  , откуда
, откуда  .
.
Порядок по [В] определяется в условиях постоянства концентрации [А]. Тогда
 , где
, где  .
.
При увеличении концентрации [В] в 4 раза имеем соотношение скоростей реакции
 .
.
Так как  , то
, то  , откуда имеем
, откуда имеем  .
.
Окончательный вид кинетического уравнения:  .
.
Пример 2. Выявление роли давления как фактора скорости реакции.
Задача 1. Во сколько раз увеличится скорость элементарной реакции  при увеличении давления в системе в 3 раза?
при увеличении давления в системе в 3 раза?
Решение. Скорость этой реакции можно выразить уравнением
 . (11)
. (11)
В соответствии с уравнением Менделеева-Клапейрона
 . (12)
. (12)
Аналогично
 (13)
(13)
Подставляя (12) и (13) в уравнение (11), имеем
 (14)
(14)
где 
При увеличении давления в 3 раза скорость реакции в соответствии с уравнением (14) составит
 (15)
(15)
Сравнивая (14) и (15), видим, что скорость реакции при увеличении давления в 3 раза увеличивается в 27 раз.
Пример 3. Влияние температуры на скорость реакции.
Задача 1. Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30оС до 70оС, если температурный коэффициент реакции равен 2?
Решение. В соответствии с уравнением Вант-Гоффа
 .
.
При повышении температуры на 40о скорость реакции увеличится в 16 раз.
Пример 4. Определение времени протекания реакции в зависимости от температуры.
Задача 1. При 393К реакция завершается за 10 минут. Сколько времени будет продолжаться реакция при 363К, если температурный коэффициент этой реакции равен3?
Решение. В соответствии с уравнением Вант-Гоффа

Поскольку между скоростью реакции и временем ее протекания существует обратно пропорциональная зависимость, то

Подставляя в левую часть уравнения Вант-Гоффа вместо 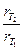
 имеем
имеем
 , откуда
, откуда
 .
.
При температуре 363К реакция закончится за 4,5 часа.
Пример 5. Влияние температуры на константу скорости.
Задача 1. Во сколько раз увеличится скорость реакции при повышении температуры от 30о до 60о, если ее энергия активации составляет 80 кДж/моль?
Решение. Скорость реакции можно представить кинетическим уравнением

При сопоставлении скоростей реакции при разных температурах имеем
 .
.
В соответствии с уравнением Аррениуса
 .
.
Подставляя значения  в последнее выражение, имеем
в последнее выражение, имеем

Пример 6. Вычисление равновесных концентраций реагирующих веществ.
Задача 1. Реакция протекает по уравнению  . Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны: 4 и 6 моль/л, константа равновесия К = 1.
. Определите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны: 4 и 6 моль/л, константа равновесия К = 1.
Решение. К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. На каждый моль вещества А и В образуется 2 моль вещества С. Поэтому если понижение концентрации вещества А и В обозначить через х моль, то увеличение концентрации вещества С будет 2х моль.
Тогда равновесные концентрации реагирующих веществ:

В соответствии с выражением для константы равновесия
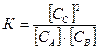 имеем
имеем  , откуда
, откуда  .
.
Решение этого уравнения дает значение х= 1,62.
Отсюда равновесные концентрации реагирующих веществ равны:

Пример 7. Влияние изменения концентрации реагирующих веществ на смещение равновесия.
Задача 1. В результате протекания химической реакции  установилось равновесие, которому соответствуют концентрации реагентов
установилось равновесие, которому соответствуют концентрации реагентов  ,
,  ,
,  ,
,  . Как изменится концентрации компонентов при резком снижении концентрации эфира до 0,5 моль/л?
. Как изменится концентрации компонентов при резком снижении концентрации эфира до 0,5 моль/л?
Решение. Резкое снижение концентрации продукта реакции приводит к нарушению равновесия. В соответствии с принципом Ле-Шателье система стремится восполнить возникший дефицит концентрации эфира путем протекания процесса слева направо до нового состояния равновесия. Обозначим количество дополнительно образующегося эфира в результате вновь установившегося равновесия через х. Тогда новый состав равновесной смеси в соответствии со стехиометрией реакции будет выглядеть следующим образом:

Константа равновесия в соответствии с результатами ранее установившегося равновесия
 .
.
Новое состояние равновесия характеризуется той же константой
 , откуда
, откуда

 .
.
Это уравнение имеет два решения
 ;
;  .
.
Первое, как не имеющее физического смысла, отбрасываем и принимаем  . Новому состоянию равновесия соответствуют следующие концентрации компонентов
. Новому состоянию равновесия соответствуют следующие концентрации компонентов



 .
.
Пример 8. Влияние изменения температуры, давления и концентрации на смещение химического равновесия.
Задача 1. Реакция синтеза метанола протекает по уравнению  ,
, 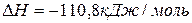 .
.
Как надо изменить температуру, давление и концентрацию, чтобы сместить равновесие в сторону образования метанола.
Решение. А) Поскольку реакция экзотермическая, то на повышение температуры (нагревание) система в соответствии с принципом Ле-Шателье реагирует развитием процесса, который ослабляет это воздействие. Это процесс поглощения тепла, т.е. реакция, обратная синтезу метанола. Таким образом, при повышении температуры равновесие смещается в сторону исходных реагентов. Соответственно, чтобы сместить равновесие в сторону образования метанола, температуру необходимо понижать.
Б) На увеличение объема система в соответствии с принципом Ле-Шателье стремится ослабить это воздействие, принимая меньший объем. Поскольку уменьшение объема соответствует протеканию реакции в сторону образования метанола, то с повышением давления равновесие смещается в правую сторону. Поэтому для смещения равновесия в сторону образования метанола давление необходимо повышать.
В) Применение избытка одного из реагентов является фактором смещения равновесия в сторону образования метанола. Благодаря избытку реагента создается его сверхравновесная концентрация, и реакция протекает в направлении, обеспечивающем снижение этой концентрации, т.е. в сторону образования метанола.
Растворы
Растворы - это гомогенные системы переменного состава, состоящие из двух или более компонентов. Любой раствор состоит из растворённого вещества и растворителя.
Растворитель - это компонент, который в растворе находится в том же агрегатном состоянии, что и до растворения. Например, в водном растворе глюкозы растворителем является вода, а глюкоза - растворённое вещество.
Date: 2016-11-17; view: 457; Нарушение авторских прав