
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Д - элементами ЭСИ; е-утоплением
|
|
Опорных лент.
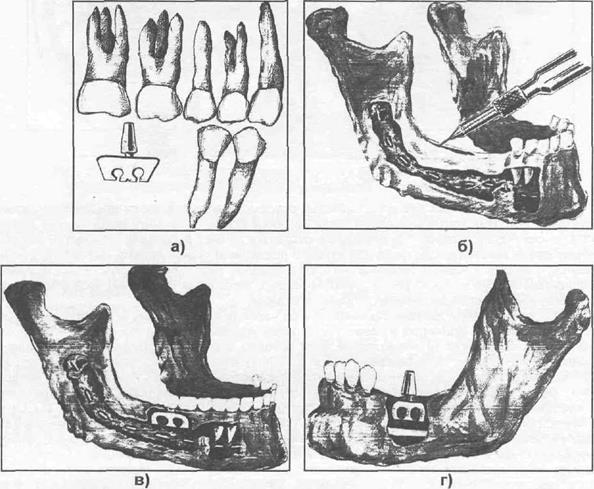
Субпериостальная имплантация впервые была описана N.Goldberg и A. Gershkoff в 1949 году. В классическом варианте она выполняется в два этапа: первый этап — отслаивают слизисто-надкостничный лоскут в области предполагаемого места расположения имплантата и снимают оттиск, второй этап — устанавливают имплантат на место. Субпериостальные им- плантаты изготавливаются из металла, преимущественно титана и его сплавов. Субперио- стальный имплантат состоит из следующих элементов: головки, шейки и опорной части. Опор- ная часть в свою очередь включает вестибулярную и оральную ветви, опорные плечи (ленты) и
35.1. ВИДЫ ДЕНТАЛЬНОЙ ИМПЛАНТАЦИИ
 стабилизирующие балки, фиксирующие приспособления. Данные имплантаты могут быть час- тичными или полными (тотальный). Частичный имплантат изготавливается на определенный участок альвеолярного отростка челюсти (при частичной адентии), полный — на всю челюсть (при полной адентии). В последние годы все чаще врачи отказываются от применения полных (тотальных) субпериостальных имплантатов, а изготавливают несколько конструкций (чаще 2-3) частичных субпериостальных имплантатов. Способы фиксации субпериостальных имплантатов могут быть различными (рис. 35.1.9). Для устранения недостатков металлических имплантатов мы рекомендуем шейку и опорную часть (находящуюся под и соприкасающуюся со слизисто- надкостничным лоскутом) покрывать биоинертной керамикой — оксидом алюминия (А.А. Тимо- феев, О.И. Бижан, 1998).
стабилизирующие балки, фиксирующие приспособления. Данные имплантаты могут быть час- тичными или полными (тотальный). Частичный имплантат изготавливается на определенный участок альвеолярного отростка челюсти (при частичной адентии), полный — на всю челюсть (при полной адентии). В последние годы все чаще врачи отказываются от применения полных (тотальных) субпериостальных имплантатов, а изготавливают несколько конструкций (чаще 2-3) частичных субпериостальных имплантатов. Способы фиксации субпериостальных имплантатов могут быть различными (рис. 35.1.9). Для устранения недостатков металлических имплантатов мы рекомендуем шейку и опорную часть (находящуюся под и соприкасающуюся со слизисто- надкостничным лоскутом) покрывать биоинертной керамикой — оксидом алюминия (А.А. Тимо- феев, О.И. Бижан, 1998).
Рис. 35.1.10. Эндооссально-субпериостальный имплантат О.Н. Сурова.
Эндооссально-субпериостальная имплантация (ЭСИ) включает элементы последних двух ранее указанных имплантаций. Конструкция эндооссально-субпериостального имплантата представлена следующими элементами: головкой, шейкой, субпериостальной и эндооссальной частями. Одним из типичных представителей данного вида имплантата является эндооссально- субпериостальный имплантат О.Н. Сурова {рис. 35.1. Щ.
ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ДЕНТАЛЬНОЙ ИМПЛАНТАЦИИ. ВЫБОР КОНСТРУКЦИИ ИМПЛАНТАТА
Показаниями к дентальной имплантации являются:
• частичные дефекты зубных рядов во фронтальном или в концевых отделах;
• полное отсутствие зубов у пациентов без атрофии и с атрофией альвеолярных отро- стков челюстей;
• лица, которые не могут пользоваться съемными протезами (повышен рвотный реф- лекс, аллергические реакции на пластмассы, деформации челюстей врожденного и приобретенного характера).
Дентальная имплантация проводится у лиц молодого и среднего возраста. Однако у па- циентов пожилого возраста, при хорошем общем состоянии и отсутствии противопоказаний, также возможно ее выполнение.
Противопоказания к проведению зубной имплантации могут быть абсолютные и отно- сительные, общие и местные.
Абсолютными противопоказаниями я в ляются: '
• хронические соматические заболевания организма (туберкулез, коллагеновые аутоиммунные заболевания - ревматоидный артрит или синдром Шегрена и др.);
• тяжелые заболевания сердечно-сосудистой системы;
• эндокринные заболевания (сахарный диабет, токсический зоб, нарушение функции гипофиза или надпочечников и др.);
• заболевания костной системы (дисплазии, остеодистрофии, остеопороз);
• системные заболевания соединительной ткани (красная волчанка, склеродермия и др.);
• болезни крови и кроветворных органов (лейкоз, агранулоцитоз, коагулопатии, анемии и др.);
• психические заболевания (психозы, неврозы и др.);
• лучевая болезнь;
• хронический алкоголизм;
«51
• наркомания;
35. ДЕНТАЛЬНАЯ ИМПЛАНТАЦИЯ
• наличие злокачественных опухолей (неоперабельные опухоли, лечение химиотера- пией, лучевая терапия большими дозами).
Относительные общие противопоказания:
• заболевания, связанные с недостатком поступления витаминов в организм (авитами- нозы);
• респираторные заболевания;
• специфические заболевания (сифилис, актиномикоз);
• предоперационная лучевая терапия злокачественных опухолей на ранних их стадиях развития в органах и тканях, расположенных вдали от челюстно-лицевой области;
• диспротеинемия, обусловленная неполноценностью белкового питания;
• дисменорея;
• беременность;
• инфекционные заболевания;
• в период ухудшения общего состояния организма, обусловленного разнообразными причинами (повышением артериального давления и др.);
• обострения хронического течения воспалительных заболеваний в различных органах и тканях;
Абсолютными местными противопоказаниями для дентальной имплантации могут служить:
• злокачественные опухоли мягких тканей и костей лицевого скелета;
• доброкачественные опухоли и опухолеподобные образования (дисплазии) челюстей;
• лучевой некроз челюстей (остеорадионекроз);
• наличие предоп ухолевых заболеваний красной каймы губ или слизистой оболочки полости рта;
• наличие клинической симптоматики непереносимости металлов (относится для ме- таллических конструкций имплантатов);
• тяжелая форма генерализованного пародонтита и пародонтоза;
• идиопатические заболевания с прогрессирующим поражением (лизисом) тканей пародонта (синдром Папийона - Лефевра и др.);
• системные заболевания соединительной ткани с проявлением их в челюстно-лицевой области;
• низкая гигиеническая культура пациента или нежелание его к поддерживанию высокой гигиены полости рта.
Относительные местные противопоказания:
• обострение хронических (периодонтит, периостит и др.) и наличие острых (абсцесс, флегмона и т.д.) воспалительных процессов в мягких тканях и челюстях;
• деструктивные процессы в челюстях неопухолевого происхождения (остеомиелит, кисты) при условии включения в комплекс их лечения заполнения послеоперационных костных дефектов остеопластическими материалами (биоинертной или биоактивной керамикой и др.);
'• •• гингивиты, стоматиты, тонзиллиты, гаймориты;
• при проведении лечения заболеваний периферической нервной системы (невралгии, невриты и др.);
• заболевания височно-нижнечелюстного сустава (артрит, артрозы, дисфункции);
• патологический прикус;
• неудовлетворительное состояние гигиены полости рта.
Конечно же этим кратким списком нельзя учесть все возможные заболевания и состоя- ния, которые могут явиться причиной развития осложнений при проведении дентальной им- плантации. Поэтому, врачу необходимо быть особенно внимательным и вдумчивым при предо- перационном обследовании пациента и выборе его для выполнения операции дентальной им- плантации.
После принятия положительного решения по проведению дентальной имппантации, вра- чу необходимо провести обоснование выбора материала и конструкции имплантата. Конструк- ция имплантата выбирается исходя из топографо-анатомических особенностей зубных рядов и челюстей пациента. Во фронтальном отделе используются имплантаты цилиндрической формы, а в дистальных — пластиночные и цилиндрические имплантаты.
35,2. ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ КДЕНТАЛЬНОЙ ИМПЛАНТАЦИИ...
По мнению Г.М. Вайса (1992) выбор конструкции имплантата зависит также и от вида альвеолярного отростка челюсти. При широком альвеолярном отростке могут использо- ваться как цилиндрические, так и пластиночные конструкции имплантатов. Если альвеоляр- ный отросток средней ширины, то преимущество имеют пластиночные имплантаты перед цилиндрическими. При узком альвеолярном отростке показана не эндооссальная, а субпе- риостальная имплантация.
 По мнению К.П. Константину (1997) при имплантации необходимо учитывать толщину слизисто-надкостничного лоскута, расположенного по гребню альвеолярного отростка челю- сти, ширинуегокостнойчасти и размерпетель-лакунгубчатоговеществакости в запла- нированных местах его введения. Автором отмечено, что у пациентов с толщиной слизисто- надкостничного лоскута, расположенного по гребню альвеолярного отростка челюсти в 1-5 мм и шириной его костной части 3,5-5,5 мм рентгенологически выявляется среднепетлистое (1-2 мм) губчатое вещество кости. При толстом (5 мм и более) слизисто-надкостничном лоскуте по греб- ню альвеолярного отростка и узкой (до 3,5 мм) его костной части — мелкопетлистую (до 1 мм), а при тонком (до 1 мм) слизисто-надкостничном лоскуте альвеолярного гребня и широкой (бо- лее 5,5 мм) его костной части — крупнопетлистую (более 2 мм) губчатую структуру кости (рис. 35.2.1).
По мнению К.П. Константину (1997) при имплантации необходимо учитывать толщину слизисто-надкостничного лоскута, расположенного по гребню альвеолярного отростка челю- сти, ширинуегокостнойчасти и размерпетель-лакунгубчатоговеществакости в запла- нированных местах его введения. Автором отмечено, что у пациентов с толщиной слизисто- надкостничного лоскута, расположенного по гребню альвеолярного отростка челюсти в 1-5 мм и шириной его костной части 3,5-5,5 мм рентгенологически выявляется среднепетлистое (1-2 мм) губчатое вещество кости. При толстом (5 мм и более) слизисто-надкостничном лоскуте по греб- ню альвеолярного отростка и узкой (до 3,5 мм) его костной части — мелкопетлистую (до 1 мм), а при тонком (до 1 мм) слизисто-надкостничном лоскуте альвеолярного гребня и широкой (бо- лее 5,5 мм) его костной части — крупнопетлистую (более 2 мм) губчатую структуру кости (рис. 35.2.1).
Рис. 35.2.1. Крупно - (а), средне - (б) и мелкопетлистая (в) структура костной ткани челюсти в месте запланированного
введения имплантата (по К.П. Константину).
U. Lekholm, A. Zarb (1985), P.J. Branemark и соавт. (1986) рекомендуют учитывать не толь- ко общий объем костной ткани, но и структурное строение костей челюстей. Это позволило авторам выделить 4 типа челюстей:
1 - почти вся толщина челюсти состоит из гомогенной компактной кости;
2 - толстый слой компактной кости, размещенный вокруг плотной трабекулярной кости; 3 - тонкий слой компактной кости охватывает плотную трабекулярную кость;
4 - тонкий слой компактной кости окружает рыхлую трабекулярную кость.
В.Л. Параскевич (1998) считает, что следует выделять три основных типа архитектоники
челюстных костей:
I тип - кость повышенной плотности. Губчатый слой тонкий и представлен мощными тра- бекулами. Соотношение компактного и губчатого слоев может быть выражено в пропорции 2:1; II тип - кость средней плотности. Губчатый слой представлен хорошо развитой сетью крепких трабекул и окружен компактным слоем кости толщиной 2-3 мм. Соотношение компакт-
ного и губчатого слоев 1:1;
III тип - губчатый слой представлен немногочисленными тонкими трабекулами и окружен компактным слоем, толщина которого не превышает 1 мм. Соотношение компактного и губчато-
35. ДЕНТАЛЬНАЯ ИМПЛАНТАЦИЯ
го слоев - меньше, чем 0,5:1. Данный тип архитектоники соответствует состоянию регионарно- гоостеопороза.
При строении костной ткани челюсти, которое соответствует I и II типу, автор предпочте- ние отдает винтовым и цилиндрическим имплантатам, т.к. при этих типах архитектоники имеют- ся условия для достижения остеоинтеграции.
По мнению Р.А. Левандовского (1996) имплантат должен быть такой толщины, чтобы по- сле его введения в альвеолярный отросток челюсти толщина костных стенок не должна быть меньше толщины самого имплантата. То есть, толщина имплантата должна быть не более 1/3 ширины альвеолярного отростка челюсти.
МЕТОДИКА ИМПЛАНТАЦИИ
Методику имплантации рассмотрим на примере введения эндооссальных металличе- ских пластиночных имплантатов.
Операцию проводят под проводниковым обезболиванием. Разрез слизистой до кости де- лается по вершине альвеолярного гребня. Длина его обычно превышает размеры имплантата на 1 см. Отслаивается слизисто-надкостничный лоскут для обнажения гребня альвеолярного отростка. Фиссурным твердосплавным бором или сверлом из набора для имплантации про- сверливают вертикальный канал по переднему краю места будущего нахождения пластиночно- го имплантата, а затем и по заднему краю. Соединив каналы между собой, образуют костное ложе для имплантата. До введения имплантата измеряют глубину, длину и ширину костного ложа с помощью аналога имплантата, который на 0,2 мм тоньше вводимого имплантата. Кост- ную стружку удаляют с помощью костной ложки или путем промывания костной раны изотони- ческим раствором хлорида натрия. Следует знать, что при подготовке костного ложа необходи- мо проводить охлаждение кости, т.к. уже при температуре 47°С она теряет свои репаративные способности (Т. Albrentsson, 1983; J. Ericsson et al., 1991). Для охлаждения кости используют физиологический раствор (изотонический раствор хлорида натрия). Р.А. Левандовский (1996) рекомендует его охлаждать до 8 - 13 °С, а О.Н. Суров (1993) - до 15 - 20 °С.
Чтобы избежать перегрева кости следует пользоваться низкооборотистыми бормашина- ми. К.П. Константину (1997) рекомендует у пациентов с крупнопетлистой костной тканью, для ее атравматичной препаровки, использовать скорость вращения препарирующего инструмента равную 2000 об/мин, средне петлистой костной тканью - 3000 об/мин, а мелкопетлистой - 5000 об/мин.
Путем легкого постукивания молотком по имплантату его вводят в подготовленное кост- ное ложе. Имплантат должен быть полностью погружен в кость. Толщина костной стенки над верхней внутрикостной горизонтальной пластинкой имплантата не должна быть менее 2-3 мм, т.е. имплантат должен находиться глубже гребня альвеолярной кости. До нижнечелюстного ка- нала или до верхнечелюстной пазухи толщина костной стенки не должна быть менее 2-Змм. Слизисто-надкостничный лоскут укладывают на место и тщательно сшивают его вокруг шейки, а при избытке лоскута вырезают последний вокруг шейки имплантата и сшивают нерассасы- вающими швами. Швы снимают не ранее, чем на 7-е сутки после операции. Следует помнить, что между опорной частью имплантата и зубами-антагонистами необходимо оставлять проме- жуток (пространство) не менее 3 мм.
Схематично операция эндооссальной имплантации пластиночными имплантатами конст- рукции В.В. Лось представлена на рис. 35.3.1. Пластиночные имплантаты устанавливаются од- ноэтапно.
При операции введения цилиндрических или конических имплантатов необходимо помнить, что имплантаты для одностадийной имплантации вводятся в кость путем их ввинчи- вания на всю глубину его до шейки, а для двухстадийной имплантации — на всю его глубину, т.е. до уровня края альвеолярного гребня челюсти (над этим имплантатом тщательно сшивают- ся слизисто-надкостничные лоскуты - первый этап операции, а на втором этапе вырезается окошко в мягких тканях над имплантатом). Период между первым и вторым этапом состав- ляет от 3-х до 6-ти месяцев. Глубину отверстия для цилиндрических (конических) имплантатов контролируют глубиномером.
Принципиальных отличий при введении керамических имплантатов нет. По нашему мнению, лучшее заживление наблюдается при препаровке костной ткани инструментами с час- тотой вращения 1500 об/мин (А.А. Тимофеев, А.Н. Лихота, 1993). При формировании костного ложа для пластиночных полукруглых керамических имплантатов желательно пользоваться цир- кулярной пилой.
Если при подготовке костного ложа для имплантата выяснено, что его размеры превышают таковые имплантата, то костный дефект следует заполнить биоинертной или
35.3. МЕТОДИКА ИМПЛАНТАЦИИ
биоактивной керамикой (оксид алюминия, кергап, осте о гель и т.п.) до плотной (устойчи- вой) фиксации имплантата.
После проведения операции имплантации необходимо строго соблюдать гигиенический уход за полостью рта и зубными имплантатами. В течение первой недели после операции, по- сле каждого приема пищи, рекомендуется проведение антисептического полоскания полости рта (раствором хлоргексидина, отваром из лекарственных трав и др.), а в дальнейшем - меха- ническая (зубными щетками) и химическая их очистка (зубными пастами с антимикробным и припятствующим отложению зубного камня действием).
 д)
д)
Рис. 35.3.1. Операция эндооссальной имплантации. Схематичное соотношение зубов и пластиночного имплантата конструкции
В.В. Лось (а). Схема дентальной имплантации на нижней челюсти (б, в). Расположение имплантата на нижней и верхней челюстях (г, д).
Этапы проведения дентальной имплантации на нижней челюсти (е, ж).
35. ДЕНТАЛЬНАЯ ИМПЛАНТАЦИЯ
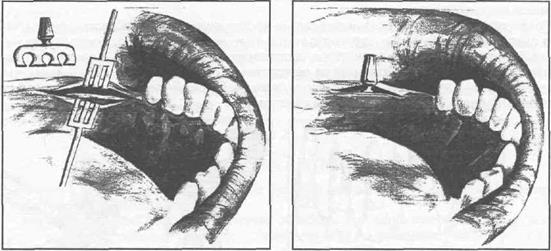
е) ж)
Рис. 35.3.1. (продолжение).
Известно, что успех при использовании современных имплантатов предсказуем, однако проблема создания эпителиально-десневои (биологической) перемычки вокруг шейки имплан- тата до сих пор не решена. Эта перемычка создается за счет рубцевания слизистой оболочки вокруг шейки имплантата, которая для лучшего прилегания тканей должна иметь округлую или овальную форму. С целью создания антибактериальной перемычки в области шейки зубного имплантата А. Суров (1998) рекомендует проводить напыление (покрытие) этой зоны ионами серебра, обладающего противомикробным действием.
Остеоинтеграция дентальных имплантатов челюсти к настоящему времени изучена мно- гими авторами. PJ. Branemark и соавт. (1977, 1985) указывают, что на поверхности титанового имплантата образуется титанооксидный слой, который и создает возможность для сращения имплантата с костью. Т. Albrektsson и соавт. (1981) отмечают, что основными факторами, влияющими на течение остеоинтеграции являются: биосовместимость используемого материа- ла к тканям; макро - и микроформа имплантата; состояние костной ткани; степень травматич- ности примененной операционной техники; функциональная нагрузка на имплантат. LJ. Linkow и соавт. (1977, 1995) и P.J. Branemark и соавт. (1986) считают, что в пластиночных имплантатах одновременно можно встретить 3 типа сращения имплантата с костью: фиброзный, фиброз- но-остеоидный и остеоидный. Авторы отличают, что последний тип сращения бывает в том случае, если имплантат плотно контактирует с кортикальной костью челюсти, а при фиброзно- остеоидном типе имеется пространство между костью, заполненное плотной фиброзной тка- нью. Аналогичная остеоинтеграция наблюдается и при цилиндрических формах титановых им- плантатов (Ю.В. Вовк и соавт. 1996). Сравнительное изучение особенностей остеоинтеграции имплантатов из нержавеющей стали и сапфира провел В.И. Куцевляк и соавт. (1995, 1998). Ус- тановлено, что вокруг имплантатов из сапфира формируется костно-сапфировый блок по типу остеоинтеграции. По ходу имплантационного ложа перестройка ткани ведет к формированию костных структур, что соответствует компактной костной ткани. При плотном соприкосновении керамического имплантата с костью не создаются условия для врастания эпителия. У имплан- татов из кадора формировалось сращение по типу фиброзно-остеоидного (Н.Б. Гречко, 1998).
В последние годы нами разработаны и успешно применены как электрохимический спо- соб определения биосовместимости металлических имплантатов в стоматологии, так и способ оптимизации репаративной регенерации костной ткани в имплантологии. До настоящего време- ни недостаточно изучены величины возникающих в полости рта гальванических токов при при- менении металлических имплантантов с последующим протезированием, а также влияние этих токов на регенерацию костной ткани и возможность появления осложнений в послеоперацион- ном периоде. Для ускорения адаптации сапфирового имплантата Н.Б. Гречко (1998) рекомен- дует применять гелий-неоновый лазер.
В отношении сроков начала проведения зубного протезирования на имплантатах сущест- вуют две точки зрения.
Одни авторы считают, что в период репаративной регенерации (остеоинтеграции) необ- ходимо обеспечить покой — отсутствие нагрузок на имплантат для создания условий благо- приятного ее течения (Т. Albrektsson et al, 1981; P.J. Branemark et al., 1987; B.B. Лось и соавт.,
35.3. МЕТОДИКА ИМПЛАНТАЦИИ
1987; Т.Г. Робустова и соавт., 1990; А.С. Дудко, 1993; Ю.В. Вовк и соавт., 1996; А.А. Тимофеев, 1997, R.Vollter, M.Tamimi, 1999 и др.). Протезирование начинают ориентировочно через 3-6 ме- сяцев после завершения дентальной имплантации. Только имплантаты с регулируемой систе- мой фиксации можно нагружать в ранние сроки (рис. 35.3.2).
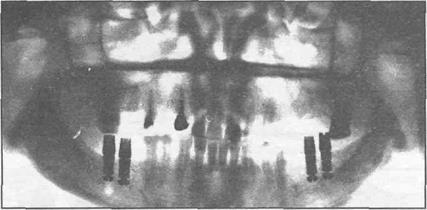
Рис. 35.3.2. Рентгенограмма нижней челюсти больного с применением внутрикостных имплантатов с регулируемой системой фиксации.
Другие же авторы полагают возможным после операции давать ранние функциональ- ные нагрузки на имплантат, что стимулирует процессы репаративной регенерации (L.J. Linkow,
R. Chercheve, 1970, J.B. Brunski et al., 1979; K.W. Judy, 1986; O.H. Суров, 1986; Бахерли Насер,
M.M. Угрин, 1992; М.М. Угрин и соавт., 1994, Р.А. Левандовский, 1996 и др.).
При двухстадийной имплантации цилиндрическими имплантатами, по мнению К.П. Кон- стантину (1997) второй хирургический этап следует начинать через 3-5 мес. при среднепетли- стом строении костной ткани, через 4-6 мес. - при мел ко петли стой и 6-8 мес. - при крупнопет- листой структуре костной ткани челюсти.
Синуслифтинг ("Sinus-Lift") - операция поднятия дна верхнечелюстной пазухи. Приме- няется при пневматическом типе последней или при выраженной атрофии альвеолярного отро- стка верхней челюсти. Цель операции - создание условий для имплантации. Имплантаты уста- навливаются как одновременно с проведением операции, так и через 6-8 месяцев после неё. При выполнении операции синуслифтинга (рис. 35.3.3) важно не перфорировать слизистую оболочку верхнечелюстной пазухи, т.к. это может привести к развитию воспалительного про- цесса в ней. Образовавшаяся полость заполняется биоактивной керамикой (кергапом и т.п.). Для создания условий для регенерации кости, последнюю закрывают биодеградирующей мем- браной (Lioplant).

Рис. 35.3.3. Этапы проведения операции поднятия дна верхнечелюстной пазухи: внешний вид участка верхнечелюстной кости где будет проводиться операция (а); отслойка слизисто- надкостничного лоскута (б); «вламывание» передней стенки верхнечелюстной кости (в); смещение костно-слизистого лоскута дна верхнечелюстной пазухи и образование полости (г); заполнение полости биоактивной керамикой (д, е); керамику покрывают биодеградирующей мембраной (ж); слизисто-надкостничный лоскут уложен на место и послеоперационная рана зашита (з).
35. ДЕНТАЛЬНАЯ ИМПЛАНТАЦИЯ

Рис. 35.3.3. (продолжение).
Существует мнение, что длительный клинический успех протезирования на зубных им- плантатах зависит от рационального распределения давления на имплантат, которое транс- формируется на костную ткань.
М. Perel (1977) считает, что смоделированная коронка должна иметь жевательную пло- щадь на 1/3 меньше площади естественного зуба и умеренно выраженный экватор, а край ее должен истончаться и сходить на нет.
В.В. Лось (1985) рекомендует, чтобы промежуточная часть протеза, расположенного на имплантате, не должна превышать по протяженности три зуба.
По мнению О.Н. Сурова (1993) несъемные протезы с опорой на имплантаты имеют свои конструктивные особенности, которые выражаются в следующем:
• соотношение высоты протезной и опорной частей имплантата должно быть как мини- мум 1:1;
• протез должен передавать нагрузку на имплантат строго по его вертикальной оси;
35.3. МЕТОДИКА ИМПЛАНТАЦИИ
• протез не должен блокировать движений нижней челюсти при артикуляции;
• жевательная поверхность смоделированных зубов не должна превышать жеватель- ной площади премоляра;
• протезированию подлежат оба зубных ряда одновременно;
• исключается применение консольных конструкций протезов, укрепленных на имплан- татах;
• моделирование опорных коронок и промежуточной части протеза проводится с уче- том создания достаточно хорошего доступа к шейке имплантата для выполнения ги- гиенических процедур.
А.Ф. Коваленко и Р.А. Левандовский (1996) рекомендуют в послеоперационном периоде все виды подвижности имплантата распределить следующим образом:
Первичная стабилизация имплантата.
(1-й день после операции - подвижности нет).
Физиологическая подвижность или ее отсутствие (подвижность в этом случае обу- словлена первичным рассасыванием кости, которое наблюдается после 14-го дня).
В дальнейшем процесс заживления может проходить двумя путями.
6 первом случае происходит вторичная стабилизация имплантата (после 21-го дня):
• а). Величина трансверзальной и передне-задней составных не превышает 0,5 мм по амплитуде в верхней точке головки имплантата;
• б). Укрепление имплантата, уменьшение подвижности вплоть до полного ее исчезно- вения.
Во втором случае наблюдается патологическая подвижность имплантата (после 21 -го дня):
• а). Наличие подвижности в двух направлениях с превышением по амплитуде 0,5 мм;
• б). Наличие трансверзальной, передне-задней и вертикальной подвижности с ампли- тудой движения от 0,5 до 1,0 мм в верхней точке головки имплантата;
• в), наличие трансверзальной, передне-задней, вертикальной составных с амплиту- дой более 1,0 - 1,5 мм с развитием грануляций в костном ложе, дефектами костной ткани на рентгенограмме вплоть до полной элиминации имплантата.
Развитие патологической подвижности может быть обусловлено расширением показаний к проведению операции дентальной имплантации, нарушением техники ее выполнения, трав- мированием твердой пищей или неправильно изготовленным протезом и т.п.
Несмотря на благоприятные исходы, которые наблюдаются при проведении имплантации металлическими (рис. 35.3.4) или керамическими {рис. 35.3.5) конструкциями, возможно разви- тие осложнений как во время проведения операции, так и в послеоперационном периоде.
Во время проведения операции возможно: поломка инструмента (необходимо удалить), возникновение кровотечения при повреждении крупного костного сосуда или сосудисто- нервного пучка (требуется остановка кровотечения с помощью местных гемостатических средств, а в послеоперационном периоде возникает необходимость в лечении посттравматиче- ского неврита), вскрытие дна верхнечелюстной пазухи (к плохим последствиям это не при- водит если сохранена ее слизистая оболочка).

Рис. 35.3.4. Благоприятный исход дентальной имплантации металлическими цилиндрическими конструкциями на нижней (а) и верхней (б) челюстях (наблюдения Ю.В. Вовк).
35. ДЕНТАЛЬНАЯ ИМПЛАНТАЦИЯ

Рис. 35.3.5. Благоприятный исход дентальной имплантации керамическими цилиндрическими конструкциями на верхней челюсти {а) через 5 месяцев и на нижней челюсти (6) через два года после операции.
Критериями успешно проведенной имплантации являются следующие показатели:
• отсутствие подвижности;
• отсутствие резорбции кости в области маргинального края (вокруг шейки) и вокруг имплантата;
• глубина десневого кармана в области шейки имплантата не должна быть более 3 мм;
• нормальное состояние десны (мягких тканей) вокруг имплантата;
• отсутствие оголения конструктивных элементов имплантата.
Критерии оценки подвижности имплантата нами уже ранее рассмотрены. Величину ре- зорбции костной ткани челюсти оценивают по измерению глубины десневых карманов и по рентгенограмме. Глубина десневого кармана измеряется, как правило, в 4 участках (с щёчной и язычной или нёбной стороны, медиально и дистально). При вертикальных (кратерообразных) дефектах (резорбции) угол, образованный имплантатом и окружающей костью меньше 60. При величине угла больше 60°, потерю костной ткани следует трактовать как горизонтальнуюр езорбцию. Горизонтальная равномерная остеорезорбция по маргинальному краю в облас- ти имплантата в норме не должна превышать 1 мм. Неравномерная (косая) горизонтальная резорбция кости вокруг имплантата или вертикальная остеорезорбция указывают на небла- гополучие в послеоперационном течении.
В зоне имплантата слизистая оболочка в норме должна быть бледно-розового цвета и плотно сращена с подлежащими тканями, безболезненной. Лишь в редких случаях она может быть несколько истончена. Если слизистая оболочка над имплантатом становится гиперемиро- ванной, отечной, цианотичной или же появляются свищи, из которых вначале могут не выпячи- ваться, а в дальнейшем уже и выпячиваются грануляции, то это указывает на развитие воспа- лительного процесса в тканях, окружающих имплантат (по типу ограниченного остеомиелита). То есть возникает, так называемый П ЕРИИМПЛАНТИТ. ПЕРИИМПЛАНТИТ - это прогрессирующая по- теря периимплантатной костной ткани в сочетании с воспалением мягких тканей. На ранних стадиях периимплантита возможно проведение кюретажа для удаления разросшейся грануля- ционной ткани, эпителия, микросеквестров, очистки поверхности внутрикостной части имплан- тата от некротически измененных тканей. После промывания антисептическими растворами ре- комендую заполнять образовавшийся костный дефект биоинертной (оксид алюминия) или биоактивной (кергап, остеогель) керамикой в смеси с антибиотиками широкого спектра действия. Мягкие ткани над костным дефектом следует тщательно зашить, а поверх операционной раны уложить (пришить, привязать) йодоформный тампон. Последний удерживается не менее 7-8 дней для создания благоприятных условий для заживления раны.
Если в послеоперационном периоде имеется патологическая подвижность имплан- тата, неравномерная (косая) или вертикальная остеорезорбция с наличием глубоких десневых карманов и гноевыделение из последних, а также боль при накусывании, то имплантат рекомендуется удалить с последующим проведением ревизии костной раны. В том случае, когда удаление имплантата не проведено, то остеомиелитический очаг в зоне имплантации прогрессирует, что приводит к выталкиванию имплантата. При убыли костного вещества возможно выпячивание - протрузия - отдельных частей имплантируемой конструк-
35.3. МЕТОДИКА ИМПЛАНТАЦИИ
ции. Реимплантацию (повторную имплантацию) рекомендуем проводить только после полно- го заживления костного дефекта челюсти с последующим учетом сделанных ошибок и развив- шихся осложнений. Патологическая подвижность имплантата или перелом его головки на- блюдается при неправильной конструкции зубного протеза и перегрузке имплантата.
Проводя сравнительное изучение результатов использования пластиночных и винтовых имплантатов (6-1 0 летние сроки) Ю. Пинтсон и соавт. (1998) пришли к выводу, что успех вин- товых имплантатов был в 85%, а пластиночных- в 91 % случаев.
На сегодня отдалённые результаты дентальной имплантации принято оценивать по следующим критериям:
| Параметр | NIHConsensus Conference 1978 | Albrektssonetal., 1986; Smith and Zarb, 1989 | Предложение Spieker- mann H. 1995 |
| Подвижность | Подвижность меньше 1мм во всех направлениях | Имплантат без шины кли- нически неподвижен. | Имплантат без шины стой- кий, подвижность отсутст- вует. |
| Рентгенография | Вертикальная потеря кости меньше 1/3 длины имплан- тата | Нет периимплантатного раз- режения кости, средняя ежегодная потеря костной ткани после первого года со дня операции менее 0,2мм. | Нет периимплантатного разрежения, вертикальная потеря кости не более 4мм при двух успешных кон- трольных осмотрах. |
| Дополнительные критерии | Воспаление дёсен, кото- | Отсутствие боли, инфици- | Отсутствует повреждение |
| рое поддаётся лечению. | рования, невропатии, па- | нервов, верхнечелюстной | |
| Нет симптомов инфициро- | рестезии или повреждения | пазухи или носовой полос- | |
| вания, парестезии или | нервного ствола; естетич- | ти. Глубина периимплан- | |
| анестезии в следствие по- | но удовлетворительная | татного кармана (буккаль- | |
| вреждения нерва, нет по- | протезная реабилитация. | но, орально, медиально, | |
| вреждения верхнечелюст- | дистально) не превышает | ||
| ной пазухи и носовой по- | 5мм при двух успешных | ||
| лости. | контрольных осмотрах. | ||
| Минимальный уровень ус- пешности | 75% через 5 лет | 85% через 5 лет, 80% че- рез 10 лет. | 85% через 5 лет, 80% че- рез 10 лет, |
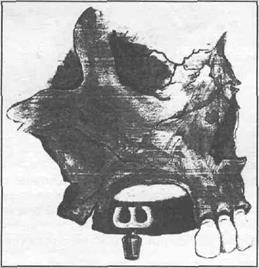
Субпериостальная имплантация проводится в 2 этапа. Методика субпериостальной имплантации заключается в том, что на первом этапе скелетируют беззубый участок альвео- лярного отростка челюсти в зоне предполагаемой имплантации, т.е. отслаивают слизисто- нэдкостничные лоскуты. Для снятия оттиска используют индивидуальные пластмассовые ложки и силиконовые оттискные материалы. После снятия оттиска слизисто-надкостничные лоскуты укладываются на место и сшиваются. После изготовления индивидуального субпериостал ьного имплантата приступают ко второму этапу операции. Повторно скелетируют альвеолярный от- росток челюсти, размещают на нем субпериостальный имплантат (опорные плечи должны быть погружены не менее, чем на 2 мм под наружную поверхность кортикальной пластинки челюсти), укладывают сверху слизисто-надкостничный лоскут и сшивают их нерассасывающими швами.
В послеоперационном периоде возможны оголения (протрузия) конструктивных элемен- тов субпериостального имплантата (перекидных опорных лент). Поэтому, Ю.Н. Зубов и А.С. Дудко (1998) отказались от изготовления в каркасах этих имплантатов перекидных лент. Единственным элементом, соединяющим щечные и оральные опорные ленты каркаса имплантата остаются только отделы, где расположены опорные головки. При развитии осложнений в виде оголения участков лент каркаса имплантата Ю.Н. Зубов и А.С. Дудко (1998) рекомендуют их удалять (срезать), предварительно отслоив слизисто-надкостничный лоскут в зоне их оголения. Эти манипуляции авторы предлагают проводить без снятия про- тезной конструкции, опирающейся на имплантат. В послеоперационном периоде возможно возникновение пролежневых язв на слизистой оболочке с последующим инфицирова- нием имплантационного ложа. Лечение, в данном случае, проводится с применением про- тивовоспалительных и кератопластических средств.
А.А. Тимофеев, "Руководство по челюсгно-лицевой хирургии и хирургической стоматологии"
Date: 2016-11-17; view: 436; Нарушение авторских прав