
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гипотензивные средства 2 page
Избыток и дефицит тестостерона. Для синдрома Кальмана характерен дефицит гонадолиберина, необходимого для нормальной функции гипофиза. При этом синдроме весьма эффективным бывает ХГ, 1000—2000 ед в/м 3 раза в сутки, и менотропин (комбинация ЛГ и ФСГ), 75 ME ФСГ и 75 ME ЛГ в/м 2 раза в неделю. Можно применять гонадорелин в импульсном режиме, 25—50 нг/кг п/к с помощью носимого дозатора каждые 2 ч. При патологии гипофиза гонадорелин бесполезен, однако высокоэффективны ХГ и менотропин. При бесплодии на фоне изолированного дефицита Л Г (синдром Паскуалини) назначают ХГ. Поскольку эти препараты предназначены для инъекций и дороги, как только в эякуляте появляются подвижные сперматозоиды, следует сразу прибегнуть к их криоконсервации. Как правило, для этого требуется 6—9 мес лечения. Частая и порой не диагностируемая причина тестикулярной недостаточности — применение анаболических стероидов, которые вместе со своими метаболитами подавляют функцию ги-поталамо-гипофизарно-гонадной системы и сперматогенез. Для начала мужчине рекомендуют отказаться от анаболических стероидов. Если уровни гормонов не восстанавливаются, функцию яичка стимулируют ХГ и ме-нотропином, как при синдроме Кальмана.
Эмпирическое медикаментозное лечение
Причина мужского бесплодия остается неизвестной в 25% случаев, которые считают идиопатическими. У части больных причина бесплодия установлена, однако патогенетическое лечение имеющейся патологии не разработано. И те, и другие больные являются кандидатами для эмпирического медикаментозного лечения. Исследованиям, посвященным этому виду лечения, присущ ряд недостатков: 1) к идиопатическим относят самые разные случаи бесплодия; 2) авторы используют разные определения бесплодия; 3) авторы по-разному оценивают улучшение свойств сперматозоидов; 4) в большинстве исследований не проведено сравнения с плацебо; 5) применяются разные схемы лечения и дозы препаратов. При назначении эмпирического лечения нужно четко знать, когда остановиться и заменить его другими методами.
Кломифен — это синтетический нестероидный препарат, действующий как антиэстроген за счет блокады эс-трогеновых рецепторов в гипоталамусе и гипофизе. У мужчин кломифен снижает и без того низкие уровни эстрогенов, способствуя выбросу гонадолиберина, ФСГ и ЛГ. Эти гормоны стимулируют секрецию тестостерона в яичке и сперматогенез. Кломифен назначают при оли-гозооспермии неясной этиологии. При сниженной под-
вижности сперматозоидов он менее эффективен. Обычная доза составляет 12,5—50 мг/сут внутрь. Препарат применяют постоянно или ежемесячно делают перерыв на 5 сут. Каждые 2—4 нед рекомендуется определять уровни гонадотропных гормонов и тестостерона и при необходимости менять дозу препарата, чтобы поддерживать нормальный уровень тестостерона. Если этот уровень слишком высок, свойства сперматозоидов ухудшаются. В отсутствие эффекта после 6 мес лечения кломифен отменяют. Хотя с 1964 г. проведено больше 30 клинических испытаний кломифена, контролируемыми были считанные из них. В большинстве испытаний эффективность кломифена, оцениваемая по повышению числа сперматозоидов и частоты беременности, не отличалась от эффективности плацебо. Также наблюдались случаи, когда кломифен снижал число сперматозоидов.
Тамоксифен обычно применяют для лечения рака молочной железы у женщин. Это тоже антиэстроген, действующий подобно кломифену, хотя, возможно, и менее эффективный. Показанием для его назначения служит олигозооспермия неясной этиологии. Тамоксифен назначают по 10—15 мг внутрь 2 раза в сутки в течение 3—6 мес. С начала лечения каждые 2—4 нед определяют уровни гонадотропных гормонов и тестостерона. Исследование спермы повторяют каждые 3 мес. Каллидиногеназа. Калликреин-кининовая система участвует в пролиферации клеток, свертывании крови и функции комплемента. Компоненты этой системы также обнаружены у мужчин в секрете семявыносящих путей. Как полагают, компоненты калликреин-кинино-вой системы способствуют транспорту сперматозоидов по женским половым путям, подвижности сперматозоидов и сперматогенезу. Калликреин — фермент, который вырабатывается поджелудочной железой и действует на кининогены с высвобождением кининов. Препарат калликреина — каллидиногеназа — применяют при оли-гозооспермии неясной этиологии, чтобы улучшить метаболизм сперматозоидов, увеличить кровоток в яичке, стимулировать функцию клеток Сертоли и семявыносящих путей. В Европе с этой целью назначают свиную каллидиногеназу, 600 МЕ/сут внутрь. Недавнее контролируемое испытание с участием 90 мужчин выявило статистически значимое увеличение числа сперматозоидов, улучшение их подвижности и поступательного движения после лечения каллидиногеназой. При этом частота беременностей в исследуемой группе составила 38%, а в контрольной (плацебо) — 16%.
Антиоксиданты. Установлено, что у 40% бесплодных мужчин в половых органах повышено содержание свободных радикалов кислорода. Считают, что эти соединения повреждают мембраны сперматозоидов, вызывая в ней перекисное окисление липидов. Повреждение могут предотвращать антиоксиданты: глутатион, 600 мг/сут в течение 3—6 мес, или а-токоферол, 400—1200 ед/сут. Соматропин. Появляется все больше доказательств, что инсулиноподобный фактор роста типа I может играть
Глава 46. Мужское бесплодие
 важную роль в сперматогенезе. Соматропин — препарат СТГ, который из-за анаболического эффекта используют спортсмены, недавно стал применяться для лечения бесплодия. В недавних клинических испытаниях, проведенных в Европе, у больных с азооспермией и отсутствием сперматогенеза после лечения соматропином в сперме появлялись сперматозоиды. Соматропин и сер-морелин могут оказаться новыми эффективными средствами для лечения олигозооспермии.
важную роль в сперматогенезе. Соматропин — препарат СТГ, который из-за анаболического эффекта используют спортсмены, недавно стал применяться для лечения бесплодия. В недавних клинических испытаниях, проведенных в Европе, у больных с азооспермией и отсутствием сперматогенеза после лечения соматропином в сперме появлялись сперматозоиды. Соматропин и сер-морелин могут оказаться новыми эффективными средствами для лечения олигозооспермии.
Искусственное оплодотворение
Если мужское бесплодие не поддается медикаментозному и хирургическому лечению, прибегают к искусственному оплодотворению.
Искусственное осеменение
Принцип искусственного осеменения — введение отмытой спермы непосредственно в полость матки. Главное показание — гибель сперматозоидов в шеечной слизи. В этом случае беременность возможна, если сперматозоиды минуют шейку матки. Другие показания — неудовлетворительные показатели исследования спермы, иммунные нарушения и пороки развития (например, гипоспадия), из-за которых нарушен транспорт сперматозоидов. Искусственное осеменение дает шансы на успех, если в эякуляте содержится 5—40 млн подвижных сперматозоидов. Эффективность этой методики очень непостоянна и зависит от репродуктивной функции у женщины. Частота беременности после одного цикла лечения при мужском бесплодия составляет 8—16%. Сроки искусственного осеменения определяют с помощью УЗИ и по уровню ЛГ в сыворотке.
Экстракорпоральное оплодотворение и микроинъекция сперматозоидов в цитоплазму яйцеклетки
Экстракорпоральное оплодотворение, технически более сложная, чем искусственное осеменение, процедура. Она позволяет избежать любых нарушений транспорта сперматозоидов по женским половым органам. Экстракорпоральное оплодотворение включает индукцию овуляции и взятие яйцеклеток из яичников под контролем УЗИ до наступления овуляции с последующим оплодотворением их в чашке Петри 0,5—5 млн сперматозоидов. Эта методика весьма эффективна при тяжелом мужском бесплодии, когда число подвижных сперматозоидов резко снижено. Экстракорпоральное оплодотворение со временем дополнили принципиально новой процедурой — микроинъекцией сперматозоидов в цитоплазму яйцеклетки (рис. 46.19). С этого времени необходимость использовать сотни сперматозоидов для экстракорпорального оплодотворения отпала, так как для микроманипуляции достаточно 1 жизнеспособного сперматозоида. В свою очередь, эта методика ускорила появление новых хирургических методов, предназначенных для получения сперматозоидов у мужчин с азо-
оспермией. Вместо эякулята для получения сперматозоидов начали использовать семявыносящие пути. В настоящее время сперматозоиды для микроинъекции в цитоплазму яйцеклетки берут из семявыносящего протока, яичка и его придатка. Недостаток экстракорпорального оплодотворения с микроманипуляциями — устранение естественного отбора, который действует при обычном оплодотворении, из-за чего генетические дефекты, вызывающие бесплодие, с высокой вероятностью наследуются потомством. Это сопряжено с целым рядом этических проблем, особенно при лечении мужчин с синдромом Клайнфельтера. Этот синдром может проявиться у внуков мужчины, страдающего излечимым благодаря современным методам бесплодием. Кроме того, недавно выяснилось, что у детей, родившихся после экстракорпорального оплодотворения, риск хромосомных аномалий в 4 раза выше, чем у детей, зачатых естественным путем.
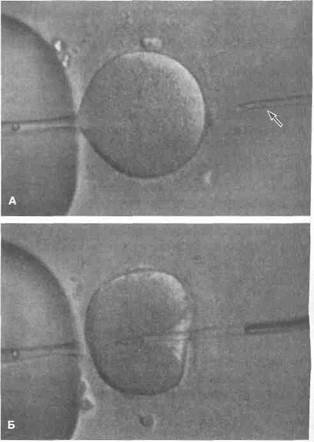
Рисунок 46.19. Микроинъекция сперматозоидов в цитоплазму яйцеклетки. А. Ооцит II порядка готовят для микроинъекции сперматозоида, которую проводят под микроскопом с помощью микропипетки (показана стрелкой). Б. Микропипетку вводят прямо в ооцит, сперматозоид попадает в его цитоплазму,
Глава 46. Мужское бесплодие
Перенос гамет в маточную трубу
Яйцеклетки для этой процедуры берут так же, как перед экстракорпоральным оплодотворением. Отличие в том, что сперматозоиды смешивают с яйцеклетками и до оплодотворения под контролем лапароскопа вводят в маточную трубу. Эта методика хороша тем, что в принципе воспроизводит нормальное оплодотворение в маточной трубе. Ее недостаток заключается в том, что проведение лапароскопии резко повышает стоимость лечения. Используя преимущества экстракорпорального оплодотворения, со временем вместо гамет начали переносить в маточную трубу эмбрион, где он обычно начинает развиваться в естественных условиях. Разновидности этой методики включают перенос в маточную трубу зиготы или зиготы на стадии пронуклеуса.
Предимплантационная диагностика
Предимплантационная диагностика позволяет достоверно подтвердить отсутствие у эмбриона генетических дефектов. Вероятность наследственных, порой опасных для жизни болезней особенно высока у детей, рожденных от больных родителей с помощью экстракорпорального оплодотворения и микроинъекции сперматозоидов в цитоплазму яйцеклетки. Пока эмбрион растет на чашке Петри, до переноса в матку из него берут одну клетку. Затем генетический материал исследуют, чтобы определить, не является ли эмбрион носителем аномальных хромосом или генов, ответственных за тяжелую патологию. Поскольку время, необходимое для исследования, сопоставимо со скоростью развития эмбриона, решение о переносе эмбриона должно быть принято за 24 ч. Потеря эмбрионом нескольких клеток не влияет на его выживаемость и не нарушает развитие.
ЛИТЕРАТУРА
Afzelius BA, Mossberg В: The immotile-ciha syndrome including Kartagener's syndrome. In: Stanbury JB et al. (editor): The Metabolic Basis of Inherited Disease, 5th ed. McGraw-Hill, 1983.
Annan J, Griffin J E: The frequency of androgen receptor deficiency in infertile men. J Clin Endocrinol Metab 1982; 54:725.
Aitken R et al.: Analysis of the relationship between defective sperm function and the generation of reactive oxygen species in cases of oligo-zoospermia. J Androl 1989; 10:214.
Aitken RJ, West K, Buckingham D: Leukocytic infiltration into the human ejaculate and its association with semen quality, oxidative stress, and sperm function. J Androl 1994; 15:343.
Amann RP, Howards SS: Daily spermatozoal production and epi-didymal spermatozoal reserves ofthe human male. J Urol 1980; 124:211.
Anguiano A et al.: Congenital bilateral absence ofthe vas deferens: A primarily genital form of cystic fibrosis. JAMA 1992; 267:1794.
Aynsley-Green A et al.: Congenital bilateral anorchia in childhood: A clinical, endocrine and therapeutic evaluation of twenty-one cases. Clin Endocrinol 1976; 5:381.
Baker WHG et al.: Protective effect of antioxidants on the impairment of semen motility by activated polymorphonuclear leukocytes. Fertil Steril 1996; 65:411.
Belker AM et al.: Results of 1,469 microsurgical vasectomy reversals by the vasovasostomy study group. J Urol 1991; 145:505.
Bennett CJ et al.: Sexual dysfunction and electroejaculation in men with spinal cord injury: Review. J Urol 1988; 139:453.
Branigan EF, Muller CH: Efficacy of treatment and recurrence rate of leukocytospermia in infertile men with prostatitis. Fertil Steril 1994; 62:580.
Burns AS et al.: A low sperm concentration does not preclude fertility in men with isolated hypogonadotropic hypogonadism after gonadotropin therapy. Fertil Steril 1988; 50:343.
Carlsen E. et al.: Evidence for decreasing quality of semen during the past 50 years. Br Med J 1992; 105:609.
Carter JN et al.: Prolactin-secreting tumors and hypogonadism in 22 men. N Engl J Med 1978; 299:847.
Carter SS, Shinohara K, Lipshultz LI: Transrectal ultrasonography in disorders ofthe seminal vesicles and ejaculatory ducts. Urol Clin North Am 1989; 16:773.
Chillon M et al: Mutations in the cystic fibrosis gene in patients with congenital absence ofthe vas deferens. N Engl J Med 1995; 332:1475.
Clarke GN, Elliot PJ, Smaila C: Detection of sperm antibodies in semen using the immunobead test. A survey of 813 consecutive patients. Am J Reprod Immunol Microbiol 1985; 7:118.
Clifton DK, Bremner WJ: The effect of testicular X-irradiation on spermatogenesis in man. J Androl 1983; 4: 387.
Coburn M, Wheeler TM, Lipshultz LI: Testicular biopsy: Its uses and limitations. Urol Clin North Am 1987; 14:551.
Cohen J et al.: In vitro fertilization: A treatment for male infertility. Fertil Steril 1985; 43:422.
Davis RO, Katz DF: Computer-aided sperm analysis: Technology at a crossroads. Fertil Steril 1993; 59:953.
DeGroot LJ: Endocrinology, 3rd ed. Saunders, 1995.
Devroey P et al.: Pregnancies after testicular sperm extraction and intracytoplasmic sperm injection in nonobstructive azoospermia. Hum Reprod 1995; 10:1457.
Dubin L, Amelar RD: Varicocele size and results of varicocelectomy in selected subfertile men with varicocele. Fertil Steril 1970; 21:606.
Enquist E, Stein BS, Sigman M: Laparoscopic versus subinguinal varicocelectomy: A comparative study. Fertil Steril 1994; 61:1092.
Fairman С et al.: The «fertile eunuch» syndrome: Demonstration of isolated luteinizing hormone deficiency by radioimmunoassay technique. Mayo Clin Proc 1968; 43:661.
Goldstein M. The Surgery of Male Infertility. Saunders, 1995.
Goldstein M et al.: Microsurgical inguinal varicocelectomy with delivery of the testis: An artery and lymphatic sparing technique. J Urol 1992; 148:1808.
Gorelick J, Goldstein M: Loss of fertility in men with varicocele. Fertil Steril 1993; 59:613.
Griffin JE: Androgen resistance: The clinical and molecular spectrum. N Engl J Med 1992; 326:611.
Griffin JE, Wilson JD: Disorders ofthe testes and male reproductive tract. In: Wilson JD, Foster DW (eds): Williams Textbook of Endocrinology, 8th ed. Saunders, 1991.
Haas GG Jr, Manganiello P: A double-blind, placebo-controlled study of the use of methylprednisolone in infertile men with sperm-associated immunoglobulins. Fertil Steril 1987; 47:295.
Handelsman DJ et al.: Young's syndrome: Obstructive azoospermia and chronic sinopulmonary infections. N Engl J Med 1984; 310:3.
Hendry WF et al.: Comparison of prednisolone and placebo in sub-fertile men with antibodies to spermatozoa. Lancet 1990; 335:85.
Hess RA et al.: A role for estrogens in the male reproductive system. Nature 1997; 390:509.
Jaffe T, Oates RD: Genetic abnormalities and reproductive failure. Urol Clin North Am 1994; 21:389.
Jeyendran RS et al.: Development of an assay to assess the functional integrity of the human sperm membrane and its relationship to other serum characteristics. J Reprod Fertil 1984; 70:219.
Kass EJ, Belman B: Reversal of testicular growth failure by varicocele ligation. J Urol 1987; 137:475.
Kent-First MG et al.: Infertility in intracytoplasmic-sperm-injec-tion-derived sons. Lancet 1996; 348:332.
Kerin JFP et al.: Improved conception rate after poor intrauterine insemination ofwashed spermatozoa from men with poor quality semen. Lancet 1984; 1:533.
Глава 46. Мужское бесплодие
 Kjessler В: Chromosomal constitution and male reproductive failure. In: Mancini RE, Martini L (eds): Male Fertility and Sterility. Academic Press, 1974.
Kjessler В: Chromosomal constitution and male reproductive failure. In: Mancini RE, Martini L (eds): Male Fertility and Sterility. Academic Press, 1974.
Kruger TF et al.: Predictive value of abnormal sperm morphology in vitro fertilization. Fertil Steril 1988; 49:112.
Lieblich JM et al.: Syndrome of anosmia with hypogonadotropic hypogonadism (Kallmann syndrome): Clinical and laboratory studies in 23 cases. Am J Med 1982; 73:506.
Lipshultz LI et al.: Testicular function after orchiopexy for unilaterally undescended testis. N Engl J Med 1976; 295:15.
Liu DY, Baker WHG: Tests of human sperm function and fertilization in vitro. Fertil Steril 1992; 58:465.
MacLeod J, Gold RZ: The male factor in fertility and infertility: Spermatozoan counts in 1000 men of known fertility and in 1000 cases of infertile marriage. J Urol 1951; 66:436.
MacLeod J, Hitchkiss RS: The effects of hyperpyrexia on spermatozoa counts in men. Endocrinology 1941; 28:780.
Madgar I et al.: Controlled trial of high spermatic vein ligation for varicocele in infertile men. Fertil Steril 1995; 63:120.
Mak V, Jarvi K: The genetics of male infertility. J Urol 1996; 156:1245.
Mather JP, Woodruff TK, Krummen LA Paracrine regulation of reproductive function by inhibin and activin. Proc Soc Exp Biol Med 1992; 20:1.
Matsuda T, Horii Y, Yoshida O: Obstructive azoospermia of unknown origin: Sites ofobstruction and surgical outcomes. JUrol 1994; 151:1543.
Matsumiya К et al.: Clinical study of azoospermia. Int J Androl 1994; 17:140.
Matthews GJ, Schlegel PN, Goldstein M: Patency following microsurgical vasoepididymostomy and vasovasostomy: Temporal considerations. J Urol 1993; 154:2070.
McClure RD: Endocrine investigation and therapy. Urol Clin North Am 1987; 14:471.
McClure RD: Evaluation of the infertile male. In: de-Vere White R (editor): Problems in Urology. Lippincott, 1987.
McClure RD: Microsurgery of the male reproductive system. World JUrol 1986; 4:105.
McClure RD, Hricak H: Scrotal ultrasound in the infertile man: Detection of subclinical unilateral and bilateral varicoceles. J Urol 1986; 135:711.
Meacham RB, Hellerstein DK, Lipshultz LI: Evaluation and treatment of ejaculatory duct obstruction in the infertile male. Fertil Steril 1993; 159:393.
Meinertz H et al.: Antisperm antibodies and fertility after vasovasostomy: A follow-up study of 216 men. Fertil Steril 1990; 54:315.
Mozaffarian GA, Higley M, Paulsen CA: Clinical studies in an adult male patient with «isolated follicle stimulating hormone (FSH) deficiency». J Androl 1983; 4:393.
Mulhall JP et al.: Azoospermic men with deletion of the DAZ gene cluster are capable of completing spermatogenesis: Fertilization, normal embryonic development and pregnancy occur when retrieved testicular spermatozoa are used for intracytoplasmic sperm injection. Hum Reprod 1997; 12:503.
Nagler HM, Deitch AD, deVere White R: Testicular torsion: Temporal considerations. Fertil Steril 1984; 42:257.
Nudell DM et al.: The mini-MESA for sperm retrieval: A study of urological outcomes. Hum Reprod 1998; 13:1260.
Okuyama M et al.: Surgical repair of varicocele at puberty: Preventive treatment for fertility improvement. J Urol 1988; 139:562.
Ovesen P et al.: Growth hormone treatment of subfertile males. Fertil Steril 1996; 66:292.
Petros JA et al.: Correlation of testicular color Doppler ultrasonography, physical examination and venography in the detection of left varicoceles in men with infertility. J Urol 1991; 145:785.
Pryor JL et al.: Microdeletions in the Y chromosome of infertile men. N Engl J Med 1997; 336:534.
Reijo R et al.: Diverse spermatogenic defects in humans caused by Y chromosome deletions encompassing a novel RNA-binding protein gene. Nat Genet 1995; 10:383.
Reijo R et al.: Severe oligospermia resulting from deletions of the Azoospermia Factorgene on the Ychromosome. Lancet 1996; 347:1290.
Rodriguez-Rigau Ы, Smith KD, Steinberger E: Varicocele and the morphology of spermatozoa. Fertil Steril 1981; 35:54.
Royle MG, Hendry WF: Why does vasectomy reversal fail? Br J Urol 1988; 57:780.
Schlegel PN, Chang TSK, Marshall FF: Antibiotics: Potential hazards to male fertility. Fertil Steril 1991; 55:235.
Schoysman R et al.: Pregnancy after fertilization with human testicular spermatozoa. (Letter.) Lancet 1993; 342:1237.
Sharlip ID: What is the best pregnancy rate that may be expected from vasectomy reversal? J Urol 1993; 149:1469.
Sigman M, Jarow JP: Medical evaluation of infertile men. Urology 1997; 50:659.
Sigman M, Lipshultz LI, Howards SS: Evaluation of the subfertile male. In: Lipshultz LI, Howards SS (eds): Infertility in the Male, 3rd ed. Mosby Year Book, 1997.
Smikle CB, Turek PJ: Hypoosmotic swelling can accurately determine the viability of nonmotile sperm. Mol Reprod Dev 1997; 47:200.
Steckel J, Dicker AP, Goldstein M: Relationship between varicocele size and response to varicocelectomy. J Urol 1993; 149:769.
Tiepolo L, Zuffardi O: Localization of factors controlling spermatogenesis in the nonfluorescent portion of the human Y chromosome long arm. Hum Genet 1976; 34:119.
Tournaye H et al.: Are there predictive factors for successful testicular sperm recovery in azoospermic patients? Hum Reprod 1997; 12:80.
Turek PJ: Immunopathology and infertility. In: Lipshultz LI, Howards SS (eds): Infertility in the Male, 3rded. Mosby Year Book, 1997.
Turek PJ et al.: Observations on seminal vesicle dynamics in an in vivo rat model. J Urol 1998; 159:1731.
Turek PJ et al.: The clinical characteristics of 82 patients with serto-li-cell only syndrome. Fertil Steril 1995; 64:1197.
Turek PJ et al.: The reversibility of anabolic-induced azoospermia. J Urol 1995; 153:1628.
Turek PJ et al.: The role of the Sertoli cell in active immunosuppression in the human testis. Br J Urol 1996; 77:891.
Turek PJ, Cha I, Ljung B-M: Systematic fine-needle aspiration of the testis: Correlation to biopsy and results of organ «mapping» for mature sperm in azoospermic men. Urology 1997; 49:743.
Turek PJ, Gilbaugh JH, Lipshultz LI: Imaging in the diagnosis and treatment of male infertility. Curr Opin Urol 1994; 4:156.
Turek PJ, Lowther DN, Carroll PA: Fertility issues and their management in men with testis cancer. Urol Clin North Am 1998; 25:517.
Turek PJ, Magana JQ Lipshultz LI: Semen parameters before and after transurethral surgery for ejaculatory duct obstruction. JUrol 1996; 155:1291.
Urban MD, Lee PA, Migeon CJ: Adult height and fertility in men with congenital virilizing adrenal hyperplasia. N Engl J Med 1978; 299:1392.
Van Steirteghem AC et al.: High fertilization and implantation rates after intracytoplasmic sperm injection. Hum Reprod 1993; 8:1061.
Veldhuis JD: Male hypothalamic-pituitary-gonadal axis. In: Lipshultz LI, Howards SS (eds): Infertility in tile Male, 3rd ed. Mosby Year Book, 1997.
Weintraub MP, De Mouy E, Hellstrom WJG: Newer modalities in the diagnosis and treatment of ejaculatory duct obstruction. J Urol 1993; 150:1150.
Whitmore WF, Kars L, Gittes, RF: The role of germinal epithelium and spermatogenesis in the privileged survival of intratesticular grafts. J Urol 1985; 134:782.
Whorton MD: Male occupational reproductive hazards. West J Med 1982; 137:521.
Wolff H, Anderson DJ: Immunohistologic characterization and quantification of leukocyte subpopulations in human semen. Fertil Steril 1988; 49:497.
World Health Organization: The influence of varicocele on parameters of fertility in a large group of men presenting to infertility clinics. Fertil Steril 1992; 57:1289.
World Health Organization: WHO Laboratory Manual for the Examination of Human Semen and Sperm-Cervical Mucus Interaction, 3rd ed. Cambridge Univ. Press, 1992.
Yarborough MA, Burns JR, Keller FS: Incidence and clinical significance of subclinical scrotal varicoceles. J Urol 1989; 141:1372.
Zamboni L: The ultrastructural pathology of the spermatozoa as a cause of infertility: The role of electron microscopy in the evaluation of semen quality. Fertil Steril 1987; 48:711.
Т.Лю
НАРУШЕНИЯ ПОЛОВОЙ ФУНКЦИИ У МУЖЧИН
Понимание патогенеза нарушений половой функции у мужчин стало возможным после целого ряда лабораторных и клинических исследований в области физиологии и фармакологии. Расширились возможности амбулаторных исследований и дифференциальной диагностики при импотенции. Появились новые лекарственные средства для приема внутрь и трансуретрального введения, разработаны более совершенные и прочные протезы полового члена. Последние научные достижения реализуются в более физиологичных методах лечения.
ФИЗИОЛОГИЯ ЭРЕКЦИИ Иннервация полового члена
Вегетативный центр эрекции расположен в ядрах боковых рогов сегментов Thl2—L2 и S2—S4. Нервные волок-
на из этих сегментов направляются к нижнему подчрев-ному сплетению, где вместе с волокнами крестцового сплетения образуют нервы, расходящиеся к тазовым органам. Нервы пещеристых тел полового члена проходят по заднебоковой поверхности семенных пузырьков и предстательной железы, затем сквозь мочеполовую диафрагму параллельно перепончатой части мочеиспускательного канала. Расположение этих нервов на уровне предстательной части мочеиспускательного канала соответствует пяти и семи часам условного циферблата, на уровне перепончатой части — трем и девяти часам. Приближаясь к луковичной части мочеиспускательного канала, нервы смещаются вверх, занимая положение, соответствующее одному и одиннадцати часам условного циферблата, и, наконец, на уровне дистального края луковичной части мочеиспускательного канала входят в корень полового члена (рис. 47.1). Часть нервных волокон прободает губчатое и пещеристые тела вместе с уретральной и глубокой артерией полового члена, другая часть проходит в составе дорсального нерва полового члена и отдает ветви к губчатому и пещеристым телам в средней и дистальной части полового члена. Конечные ветви нервов пещеристых тел полового члена иннерви-руют завитковые артерии и гладкие мышцы трабекул

|
Рисунок 47.1. Топография нервов пещеристых тел полового члена.
Глава 47. Нарушения половой функции у мужчин
 пещеристых тел. Именно эти ветви обеспечивают сосудистые изменения во время эрекции и детумесценции.
пещеристых тел. Именно эти ветви обеспечивают сосудистые изменения во время эрекции и детумесценции.
Эфферентные соматические волокна берут начало в ядре Онуфровича, лежащем в передних рогах сегментов спинного мозга S2—S4. Эти волокна проходят в составе полового нерва к луковично-губчатым и седалищно-пе-щеристым мышцам. Чувствительные волокна начинаются от рецепторов в коже и головке полового члена. Болевая и температурная чувствительность проводится передним и латеральным спиноталамическими путями, вибрационная — задними канатиками. Ощущения осязания и давления проводятся к таламусу всеми перечисленными путями. Восприятие ощущений как приятных или неприятных, видимо, зависит от прошлого опыта и интерпретации на уровне ЦНС.
Спинномозговые центры эрекции регулируются головным мозгом. В этом процессе участвуют гипоталамус, лимбическая система, передний таламус, покрышка среднего мозга, латеральные отделы черного вещества, а также вентролатеральные отделы моста и продолговатого мозга. Высшими центрами эрекции считают преопти-ческое поле и паравентрикулярное ядро гиполатамуса, центральное серое вещество и парагигантоклеточное ядро продолговатого мозга.
У человека различают три типа эрекции — рефлекторную (или контактную), психогенную (или бесконтактную) и ночную. Рефлекторная эрекция возникает при тактильном раздражении половых органов. При этом эфферентные импульсы проходят по половому нерву в задние рога крестцовых сегментов спинного мозга и заднюю серую спайку. Затем они обрабатываются вставочными нейронами, передаются в парасимпатические и двигательные ядра и достигают наружных половых органов по нервам пещеристых тел полового члена и дорсальному нерву полового члена. Рефлекторная эрекция бывает сохранена при повреждении верхних отделов спинного мозга, хотя она обычно кратковременна и не поддается произвольному контролю. Психогенная эрекция имеет более сложный механизм и возникает в ответ на эротические воспоминания, фантазии, зрительные и звуковые стимулы. Импульсы обрабатываются различными отделами головного мозга, а затем передаются к половым органам через спинномозговые центры эрекции. Основная роль в регуляции эрекции принадлежит, по-видимому, крестцовому центру, поскольку при полном разрушении крестцового отдела спинного мозга она возникает лишь у небольшой доли больных. Ночная эрекция возникает непроизвольно, без стимуляции. Ее механизм не известен. Ночная эрекция чаще всего наблюдается в фазе быстрого сна. Частота и длительность ночных эрекций существенно снижаются при гипого-надизме и на фоне лечения антиандрогенами.
Date: 2016-11-17; view: 391; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |