
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Изучение эволюции белковых доменов дает аргументы в пользу сложного мира РНК: взгляд сверху вниз
|
|
Как уже упоминалось выше, система трансляции – единственный сложный ансамбль генов, сохранившийся во всех современных клеточных формах жизни. Современная трансляционная система, содержащая около 60 универсальных белок-кодирующих генов и 40 генов структурной РНК, представляет собой наилучшим образом сохранившийся остаток LUCA(S) и лучшее свидетельство того, что в какой-то форме LUCA(S) действительно существовал (см. гл. 11). В силу исключительной консервативности системы трансляции анализ ортологических последовательностей дает крайне мало для понимания ее происхождения, которое находится за горизонтом сравнения современных форм. Реконструкция генного состава LUCA(S) указывает на сложную трансляционную систему, включающую по меньшей мере 18 из 20 аминоацил-тРНК-синтетаз (АРСаз), несколько факторов трансляции, не менее 40 рибосомных белков и некоторое число ферментов, модифицирующих рРНК и тРНК. По-видимому, у LUCA(S) ядро системы трансляции было уже полностью сформировано (Anantharaman et al., 2002).
Однако сравнение последовательностей и структур белковых компонентов и РНК внутри самой системы трансляции оказывается информативным благодаря большому числу паралогов среди соответствующих генов. Когда в реконструированном генном наборе LUCA(S) обнаруживается пара паралогичных генов, давшая ей начало дупликация, естественно, относится к более ранней стадии эволюции, и, таким образом, реконструкция последовательности древнейших дупликаций позволяет взглянуть на очень ранние этапы эволюции. История паралогичных АРСаз особенно показательна. АРСазы образуют два класса по 10 специфичностей каждый (то есть каждый класс отвечает за распознавание и активацию 10 аминокислот), с неродственными каталитическими доменами и различными наборами вспомогательных доменов. Каталитические домены АРСаз классов I и II принадлежат, соответственно, к укладкам Россмана и биотин-синтазы[126]. Анализ эволюционной истории этих белковых укладок приводит к существенным выводам o ранней эволюции трансляционных систем, и не только об этом (Aravind et al., 2002). Каталитические домены АРСаз класса I образуют лишь небольшую ветвь эволюционного древа доменов укладки Россмана. Таким образом, появлению общего предка АРСаз предшествовало множество ветвлений эволюционного пути от примитивного древнего домена к состоянию с высоким разнообразием, соответствующему LUCA(S). Существенное разнообразие доменов укладки Россмана возникло еще до серии дупликаций, приведших к возникновению, еще до эпохи LUCA(S), АРСаз различных специфичностей (см. рис. 12-2 а). Подобная эволюционная картина обнаруживается и при анализе домена биотин-синтазы, давшего начало АРСазам класса II. Даже при рассмотрении только этих двух укладок становится очевидно, что огромное структурное и функциональное разнообразие белковых доменов возникло еще до того, как появилась полноценная, состоящая из РНК и белков система трансляции современного типа.

Рис. 12-2а. Разнообразие белковых доменов, кристаллизация системы трансляции и LUCA(S): эволюция нуклеотид-связывающих доменов укладки Россмана. Указаны только достаточно хорошо изученные белки. USPA – универсальный фактор стресса А; ETFP – электронтранспортный флавопротеин; vWA – фактор фон Виллебранда А; Toprim – каталитический домен топоизомераз, праймаз и некоторых нуклеаз; ДГК – дегалогеназа галоидных кислот; Receiver – компонент двухкомпонентной сигнальной системы прокариот; TIR – широко распространенный домен белок-белкового взаимодействия в сигнальных системах прокариот и эукариот; Sir2 —деацетилаза белков (в частности, гистонов). Подробное описание см. Aravind et al., 2002 и ссылки в этой статье.

Рис. 12-2б. Эволюция нуклеотид-связывающих доменов ГТФаз и родственных им АТФаз, по данным из Leipe et al., 2002. Указаны только хорошо изученные белки. Динеин, динамин, кинезин и миозин – моторные ГТФазы и АТФазы, ассоциированные с цитоскелетом; Ras/Rho – сигнальные ГТФа-зы, ассоциированные, в частности, с эндомембранной системой эукариот; G-белки – ассоциированные с мембраной ГТФазы, функционирующие совместно с G-белок-сопряженными рецепторами; PurA и PyrG – ферменты метаболизма нуклеотидов; ArgK, аргинин-киназа, – фермент метаболизма аминокислот; Mrp и MinD – АТФазы, участвующие в клеточном делении прокариот; SRP – частица узнавания сигналов.
Эволюционный анализ обширнейшего класса фосфат-связывающих доменов (известных также как P-петли) ГТФаз, в котором множество трансляционных факторов образует компактные семейства, приводит, в сущности, к тому же результату: в последовательности эволюционных бифуркаций (ветвлений эволюционного древа), представляющей историю ГТФазного домена, трансляционные факторы также возникли сравнительно поздно (см. рис. 12-2 а; Leipe et al., 2002). ГТФазы образуют лишь одну из многих больших ветвей эволюционного древа укладки, содержащей Р-петлю, которая включает огромное разнообразие белковых доменов, связывающих НТФ (нуклеозидтрифосфаты – чаще всего субстратом является АТФ, гораздо реже ГТФ и изредка – другие НТФ) и расщепляющих β-γ-фосфодиэфирную связь (см. рис. 12-2 б). Эта укладка является самым распространенным доменом во всех прокариотах (Wolf et al., 1999b), и во всех реконструкциях генетического разнообразия LUCA(S) выявляется несколько десятков содержащих Р-петлю белков. Таким образом, интенсивная эволюция домена, содержащего Р-петлю, предшествовала не только LUCA(S), но и, что еще более удивительно, современной системе трансляции. Сама Р-петля (известная также под названием мотива Уолкера A[127], рис. 12-3), богатая глицином петля, оборачивающая фосфатный конец НТФ-субстрата, является наиболее консервативным мотивом среди всех белковых последовательностей, несомненно зафиксированным на самых ранних стадиях белковой эволюции (Gorbalenya and Koonin, 1989; Trifonov et al., 2006).

Рис. 12-3. Р-петля, древнейший и самый распространенный в белковых последовательностях мотив. На рисунке изображено выравнивание Р-петель восьми древних НТФаз, каждая из которых, по данным эволюционных реконструкций, была представлена в LUCA(S) (Mirkin et al., 2003). Для каждой линии представлены три последовательности: бактерии (Escherichia coli, Ecoli), археи (Pyrococcus abyssi, Pabys) и эукариота (дрожжи Saccharomyces cerevisiae, Scere). Белыми буквами на черном фоне обозначены аминокислотные остатки, напрямую взаимодействующие с фосфатным концом НТФ, а серым фоном – характерная гидрофобная β-последовательность, предшествующая ФСП. SRP – частица узнавания сигналов.
Таким образом, из сравнительного анализа древних паралогических отношений между белковыми компонентами системы трансляции следует бесспорный, хоть и парадоксальный, вывод: за интересным исключением основных рибосомных белков, все белки, играющие главную роль в современной трансляции, возникли в результате долгой и сложной эволюции различных белковых доменов. Возникает замкнутый круг: для возникновения этих белков требуется точная и эффективная система трансляции. Древняя система трансляции могла быть и не столь совершенной, как современная, но несомненно, что она отличалась от нее не более чем на порядок по точности и скорости, иначе белковая эволюция не стала бы возможной. Однако из всего, что нам известно о современной системе трансляции, такой уровень точности невообразим без сложного и специализированного белкового аппарата.
Итак, система трансляции ярко высвечивает парадокс Дарвина – Эйгена, присущий любому анализу возникновения сложных биологических систем: для работы эффективной и точной системы трансляции современного типа требуется множество различных белков, но для того, чтобы эти белки могли возникнуть, нужна система трансляции почти столь же совершенная, как современная. По-видимому, существует только одно возможное разрешение этого парадокса, а именно через отказ от первой части противопоставления: следует заключить, что трансляционная система, сравнимая с современной по точности и скорости, работала в отсутствие значительного разнообразия белков и, возможно, вообще без белков. Таким образом, основываясь на сравнительном анализе составных частей системы трансляции, мы должны сделать предположение о существовании сложного и разнообразного мира РНК, в котором уже действовала некая разновидность цикла Дарвина – Эйгена.
Это не все, что может нам дать сравнительный анализ: сравнение самих РНК также вскрывает важные явления и загадывает поразительные загадки. Так, анализ большой рибосомной субъединицы РНК 23S выявил иерархический сценарий последовательности дупликаций, способной привести от простой древней шпильки РНК к современной, сложной, универсально консервативной структуре рРНК (Bokov and Steinberg, 2009).
Консерватизм структуры определенных элементов последовательностей (таких как псевдоуридиновая петля) и даже сайтов модификации тРНК всех специфичностей (и, разумеется, всех видов) не оставляет сомнений в том, что все они эволюционировали от общего предка (Eigen et al., 1989). Отсюда, при сравнении современных последовательностей и структур, возникает второй парадокс эволюции трансляции. Если на некоторой стадии эволюции существовал единственный предок тРНК всех специфичностей, то как могла подобная трансляционная система действовать, точнее, как она могла обеспечивать специфичность кодирования аминокислотных последовательностей нуклеотидными? Если же на этом этапе трансляционной системы еще не существовало, то что привело к эволюции специфичной к аминокислотам тРНК?
Мы обратимся к этим и смежным вопросам ниже, но сначала следует хотя бы кратко рассмотреть центральное понятие в области исследования происхождения жизни: мир РНК.
Рибозимы и мир РНК
Центральная догма молекулярной биологии (Crick, 1970) постулирует, что информация передается от ДНК к белку посредством РНК (Фрэнсис Крик дополнил ее возможностью обратной передачи информации от РНК к ДНК после открытия обратной транскрипции):
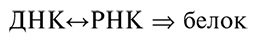
Очевидно, размышляя о происхождении первых живых форм, мы оказываемся перед вопросом типа «курица или яйцо»: что появилось первым – ДНК или белок? ген или его продукт? В такой постановке вопрос, естественно, неразрешим из-за парадокса Дарвина – Эйгена: чтобы реплицировать и транскрибировать ДНК, нужны функционально активные белки, но производство этих белков, в свою очередь, требует точной репликации, транскрипции и трансляции нуклеиновых кислот. Если строго следовать центральной догме, невозможно вообразить, каким мог быть начальный материал для цикла Дарвина – Эйгена. Даже вынесение ДНК из триады и постулат о том, что изначальный генетический материал состоял только из РНК (и сведение, таким образом, триады к диаде), хоть и является ценной идеей (см. следующую главу), но не помогает разрешить парадокс. Чтобы эволюция в сторону усложнения началась, система должна каким-то образом вступить в цикл Дарвина – Эйгена до того, как установится связь между РНК-матрицами (информационной частью системы) и белком (исполнительной частью).
Блестяще остроумное и, по-видимому, единственное решение было предложено независимо К. Вёзе, Ф. Криком и Л. Оргелом в 1967–1968 годах (Crick, 1968; Orgel, 1968; Woese, 1967): ни курица, ни яйцо, но то, что между ними, – одна РНК. Уникальным свойством РНК, делающим ее вероятным и, скорее всего, наилучшим кандидатом на главную роль в древнейшей репликационной системе, является ее способность сочетать в себе информационные и каталитические функции. Было очень заманчиво предположить, что первые репликаторные системы – первые формы жизни – состояли только из молекул РНК, действующих и как носители информации (геномы и гены), и как катализаторы различных реакций, включая в том числе синтез их самих и их предшественников. Это смелое предположение получило блестящее подтверждение с открытием и последующим изучением рибозимов (ферментов РНК): Томас Чек и коллеги в 1982 году открыли автокаталитическое расщепление интрона рРНК инфузории Tetrahymena, а в 1983 году Сидней Альтман и коллеги показали, что РНКаза P является рибозимом. Следом за этими эпохальными открытиями изучение рибозимов выросло в огромную самостоятельную и растущую область исследований (Cech, 2002; Doudna and Cech, 2002; Fedor and Williamson, 2005).
Открытие рибозимов сделало чрезвычайно привлекательной идею о том, что первые репликаторы целиком состояли из молекул РНК, катализировавших свою собственную репликацию. В 1986 году Уолтер Гилберт ввел термин «мир РНК» для обозначения этой гипотетической стадии эволюции жизни, и гипотеза мира РНК завоевала широкую популярность, став ведущей и самой популярной гипотезой о ранних стадиях эволюции. (Различные аспекты гипотезы мира РНК и подтверждающие ее данные основательно рассмотрены в одноименной книге, вышедшей в 2010 г. в 4-м издании: Atkins et al., 2010.)
Популярность гипотезы мира РНК еще более стимулировала исследования рибозимов, нацеленные на поиск разнообразных каталитических активностей РНК – в первую очередь, пожалуй, активности РНК-репликазы. Заслуживает внимания тот факт, что главным экспериментальным подходом к получению рибозимов с желаемой активностью является отбор in vitro, который, во всяком случае концептуально, воспроизводит дарвиновскую эволюцию, происходившую, как полагают, в первичном мире РНК (Ellington et al., 2009). Эксперименты по направленному отбору строятся таким образом, чтобы в случайной популяции последовательностей РНК амплифицировались только те из них, которые катализируют заданную реакцию. В многостадийных экспериментах по отбору были получены рибозимы, катализирующие весьма обширное разнообразие реакций.
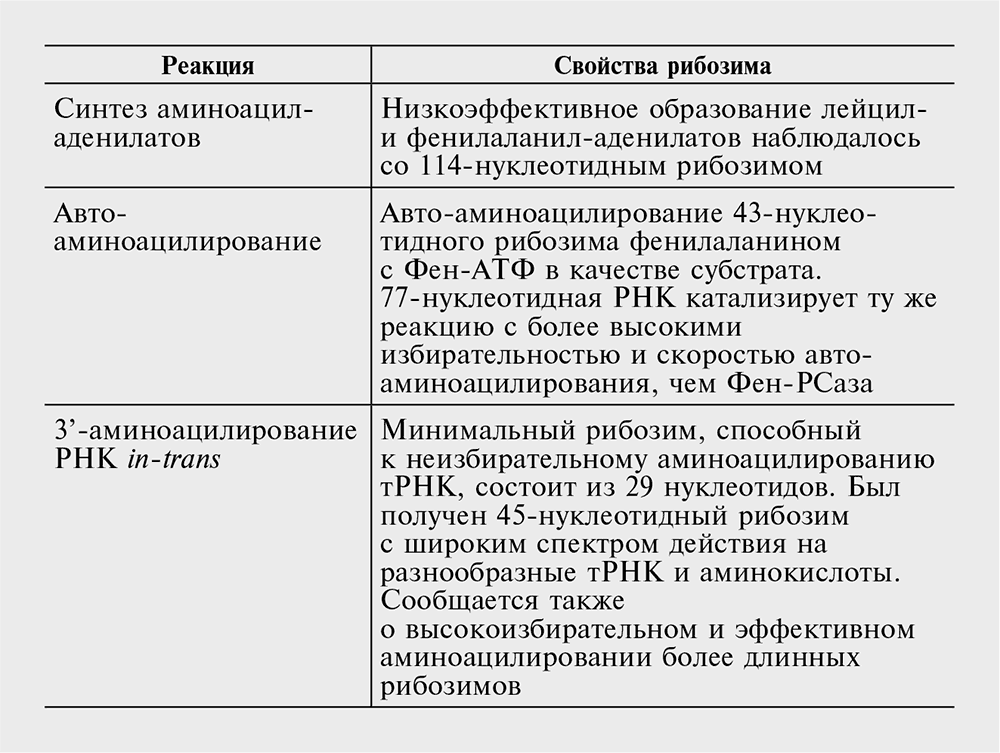
В табл. 12-1 перечислены некоторые из наиболее биологически значимых реакций, катализируемых рибозимами. Примечательно, что все три элементарные реакции, необходимые для трансляции, – (1) активация аминокислот через образование аминоацил-АМФ, (2) аминоацилирование (т)РНК и (3) транспептидация (реакция пептидилтрансферазы) – успешно моделируются с помощью рибозимов. Реакция авто-аминоацилирования, принципиально важная для возникновения первичных РНК-адаптеров (аналог АРСазы в мире РНК), была отобрана in vitro с относительной легкостью. Поразительно, что лучшие из полученных рибозимов катализируют эту реакцию с большей скоростью и специфичностью, чем соответствующие АРСазы, и что были отобраны очень короткие олигонуклеотиды, обладающие этой активностью (Turk et al., 2010).
Таблица 12-1. Некоторые из функций рибозимов, потенциально важные для биологической эволюции.

По понятным причинам, основные усилия сосредоточились на подтверждении полимеризации нуклеотидов и, в конечном счете, репликации РНК, катализируемой рибозимами, то есть ключевых процессов в гипотетическом первичном мире РНК. Результаты экспериментов, нацеленных на создание рибозимов-репликаз, до сих пор неоднозначны (Cheng and Unrau, 2010). Получены рибозимы, способные достраивать праймер после его гибридизации с матрицей (Johnston et al., 2001); на начальном этапе такие рибозимы могли действовать только путем спаривания части молекулы рибозима с матрицей, но затем были получены, путем дополнительного отбора, и общие рибозимы-полимеразы данного класса (Lincoln and Joyce, 2009). Результаты последнего прорыва в области рибозимов-полимераз были опубликованы в то время, когда окончательно редактировалась настоящая глава: рибозим-эндонуклеаза получена с использованием рибозима-полимеразы, в свою очередь построенной рекомбинацией двух уже существующих рибозимов, что в принципе представляет собой правдоподобный путь добиологической эволюции (Wochner et al., 2011). Невзирая на серьезные успехи, полученные до сих пор рибозимы-полимеразы все еще весьма далеки от достаточно точных (в смысле порога Эйгена) процессивных репликаз, способных катализировать репликацию экзогенных матриц и самих себя. Ферменты с такими свойствами, по всей видимости, являются conditio sine qua non для развития гипотетического мира РНК. Кроме того, даже имеющиеся рибозимы с ограниченными способностями РНК-полимераз довольно сложны: их молекулы состоят из приблизительно 200 нуклеотидов, и эволюция таких молекул в добиологических условиях была бы нетривиальной.
Концепция мира РНК опирается не только на каталитические способности рибозимов. Процессы мира РНК и по сей день просматриваются в живых формах, пусть и многократно затмеваемые разнообразием белков с их каталитическими и структурными функциями (Doudna and Cech, 2002). Реакции, катализируемые рибозимами, пусть малочисленные и гораздо менее разнообразные, чем катализируемые белковыми ферментами, имеют важнейшее значение в современных клетках. Первейшим примером естественных рибозимов является сама рибосома, где ключевая пептидилтрансферазная реакция катализируется рРНК большой субъединицы без непосредственного участия белков (Beringer and Rodnina, 2007)[128]. В вездесущем ферменте процессинга тРНК, РНКазе Р, собственно катализатором служит молекула РНК, в то время как белковые субъединицы играют роль кофакторов, стабилизирующих каталитическую РНК и способствующих реакции (McClain et al., 2010). Далее, самосплайсирующиеся интроны групп I и II, широко распространенные у бактерий и в органеллах растений, грибов и простейших, являются рибозимами, катализирующими свое собственное вырезание из РНК-транскриптов, часто при помощи особых белков, именуемых матуразами (см. также гл. 7). Практически не подлежит сомнению, что бесчисленное множество эукариотических сплайсосомных интронов, а также малые ядерные (мя)РНК, составляющие активные элементы эукариотических сплайсосом, произошли от интронов группы II (см. гл. 7). Таким образом, сплайсинг, вездесущий процесс в эукариотических клетках, основан на рибозимной каталитической реакции.
В мельчайших из известных инфекционных агентов, вироидах, катализируемые рибозимами реакции непосредственно участвуют в репликации: хотя полимеризация нуклеотидов и катализируется белковой полимеразой, процессинг промежуточных продуктов репликации с образованиме зрелых геномов катализируется рибозимом, содержащимся в самой молекуле РНК вироида (Flores et al., 2004). Существование и центральное значение в современных клетках этих (и, вероятно, других, все еще неоткрытых) РНК-катализируемых реакций предполагает большую роль РНК-катализаторов в начале эволюции жизни. Все эти свидетельства, конечно, далеки от доказательства реальности древнего мира РНК, как он был определен ранее – сообщество разнообразных РНК, обладающих разнообразными каталитическими свойствами и реплицируемых рибозимами-полимеразами. Тем не менее свойства современных РНК, в первую очередь рибозимная активность, полностью совместимы с таким эволюционным этапом и значительно увеличивают его привлекательность. В частности, тот основополагающий факт, что пептидилтрансферазная реакция в рибосоме катализируется рибозимом, наводит на мысль о том, что система трансляции возникла как рибозимная машина.
Таким образом, три независимые группы свидетельств сходятся в поддержку важнейшей роли РНК – а именно РНК-катализа – на самых ранних этапах истории жизни и совместимы с реальностью сложного древнего мира РНК, который Вёзе, Крик и Оргел постулировали вначале на чисто логических основаниях.
1. Сравнительный анализ белковых компонентов системы трансляции и их гомологов, выполняющих другие функции, наводит на мысль о том, что широкое разнообразие белкового мира сформировалось, когда система трансляции состояла в основном из РНК.
2. В современных клетках действует несколько классов рибозимов, и их свойства совместимы с гипотезой о том, что они являются реликтами первичного мира РНК.
3. Хотя рибозимы и менее универсальны, чем белковые ферменты, и обычно значительно уступают им в каталитической активности, они, как было показано в экспериментах по отбору, способны катализировать значительное разнообразие реакций, включая и те, что играют центральную роль в эволюции трансляции (см. табл. 12-1).
Невзирая на все эти аргументы в ее поддержку, гипотеза мира РНК сталкивается с серьезными трудностями. Во-первых, несмотря на все приложенные усилия, отобранные in vitro рибозимы оказываются (относительно) слабыми катализаторами большинства реакций; отсутствие эффективных процессивных рибозимов-полимераз представляется особенно тяжелой проблемой, но имеется также и серьезная нехватка других видов активности, в частности необходимых для синтеза нуклеотидов. Нужно признать, что было бы нереалистичным ожидать от экспериментов по эволюции рибозимов in vitro легкого воспроизведения фактической сложности изначального мира РНК. Хотя эти эксперименты и ставят на службу мощь отбора, они, очевидно, выполняются в совершенно другом временном масштабе и в условиях, неспособных точно воспроизвести (неизвестные) условия в начале жизни (мы обсудим потенциальные экологические ниши для возникновения жизни ниже в этой главе).
Исследование Э. Сатмари и сотрудников дает количественную оценку сложности, которая может быть достигнута в мире РНК, и точности репликации, необходимой для достижения этого уровня сложности (Kun et al., 2005). Оценка, основанная на функциональной устойчивости к мутациям хорошо известных рибозимов, показывает, что при частоте ошибок 10-3 на нуклеотид за цикл репликазы (это примерно соответствует точности РНК-зависимой РНК-полимеразы современных вирусов) РНК-«организм», состоящий из примерно сотни «генов» размером с тРНК (80 нуклеотидов), будет устойчивым. Такой уровень точности всего лишь на порядок выше, чем у самых точных рибозимов-полимераз, полученных отбором in vitro. Данную величину можно положить приближенной верхней границей сложности ансамблей совместно развивающихся «эгоистичных кооператоров», которые могли представлять собой «организмы» мира РНК.
Даже в лучшем случае мир РНК вряд ли обладал потенциалом эволюции дальше чрезвычайно простых «организмов». Для достижения большей сложности потребовались изобретение трансляции и «белковый прорыв» (перенос основной каталитической активности на белки). Однако силы отбора, лежащие в основе возникновения системы трансляции в мире РНК, остаются неясными, и реконструкция пути к трансляции крайне сложна. Это отсутствие ясности в отношении непрерывности эволюции от мира РНК к РНК-белковому миру является второй по значимости проблемой гипотезы мира РНК, возможно даже более существенной, чем ограниченный каталитический арсенал и (как правило) низкая эффективность рибозимов. Далее мы обсудим возможные пути выхода из этой ситуации.
Date: 2016-05-15; view: 813; Нарушение авторских прав