
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Уравнение состояния идеального газа
|
|
Состояние некоторой массы газа определяется тремя термодинамическими параметрами: давлением  , объемом
, объемом 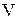 и температурой
и температурой  . Между этими параметрами существует определенная связь, называемая уравнением состояния, которое в общем виде задается выражением
. Между этими параметрами существует определенная связь, называемая уравнением состояния, которое в общем виде задается выражением  , где каждая переменная является функцией двух других.
, где каждая переменная является функцией двух других.
Французский физик и инженер Б. Клапейрон объединил законы Бойля-Мариотта, Гей-Люссака и Шарля, и вывел уравнение состояния идеального газа. Пусть некоторая масса газа занимает объем  , имеет давление
, имеет давление 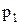 и находится при температуре
и находится при температуре  . Эта же масса газа в другом состоянии характеризуется параметрами
. Эта же масса газа в другом состоянии характеризуется параметрами 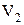 ,
, 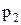 ,
,  (рис. 4).
(рис. 4).
 Переход из состояния 1 в состояние 2 происходит в виде двух процессов: 1) изотермического (изотерма
Переход из состояния 1 в состояние 2 происходит в виде двух процессов: 1) изотермического (изотерма  ), 2) изохорного (изохора
), 2) изохорного (изохора  ).
).
Согласно законам Бойля- Мариотта и Шарля:
 , (3)
, (3)
 . (4)
. (4)
Исключив из уравнений (3) - (4) 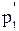 , получим
, получим
 .
.
Так как состояния 1 и 2 выбраны произвольно, то для данной массы газа величина  остается постоянной, то есть
остается постоянной, то есть
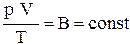 . (5)
. (5)
Выражение (5) является уравнением Клапейрона. Здесь  – газовая постоянная, различная для разных газов.
– газовая постоянная, различная для разных газов.
Русский ученый Д.И. Менделеев объединил уравнение Клапейрона с законом Авогадро, отнеся уравнение (5) к одному молю, используя молярный объем  . Согласно закону Авогадро, при одинаковых
. Согласно закону Авогадро, при одинаковых  и
и  моли всех газов занимают одинаковый молярный объем
моли всех газов занимают одинаковый молярный объем  , поэтому газовая постоянная
, поэтому газовая постоянная  будет одинаковой для всех газов. Эта постоянная обозначается
будет одинаковой для всех газов. Эта постоянная обозначается  и называется молярной газовой постоянной, она равна
и называется молярной газовой постоянной, она равна
 .
.
Уравнению
 (6)
(6)
удовлетворяет лишь идеальный газ, и оно является уравнением состояния идеального газа, или уравнением Клапейрона- Менделеева.
От уравнения (6) для моля газа можно перейти куравнению Клапейрона – Менделеева для произвольной массы газа. Если при некоторых заданных давлении и температуре один моль газа занимает молярный объем  , то при тех же условиях масса
, то при тех же условиях масса  газа займет объем
газа займет объем  , где
, где  – молярная масса газа. Уравнение Клапейрона – Менделеева для массы
– молярная масса газа. Уравнение Клапейрона – Менделеева для массы  газа
газа
 . (7)
. (7)
Часто используют другую форму уравнения состояния идеального газа, вводя постоянную Больцмана:
 .
.
Используя  , запишем уравнение состояния идеального газа (7) в виде
, запишем уравнение состояния идеального газа (7) в виде

Таким образом, из уравнения
 (8)
(8)
следует, что давление идеального газа при данной температуре прямо пропорционально концентрации его молекул (или плотности газа).
Date: 2016-05-15; view: 546; Нарушение авторских прав