
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные термодинамические функции
|
|
Внутренняя энергия U – это энергия, заключенная в рассматриваемой ТДС, которая представляет собой сумму кинетической энергии хаотичного движения микрочастиц системы. Внутренняя энергия является функцией параметров состояния, т.е. её изменение не зависит от формы пути процесса, а определяется лишь её значениями в конечном и начальном состояниях, т.е.
 .
.
Обозначив массу рассматриваемой ТДС через m (кг) и поделив внутреннюю энергию системы U на её массу, можно получить выражение для энергии, приходящейся на единицу массы, которая называется удельной внутренней энергией
 .
.
Функцией состояния ТДС называется такая физическая характеристика системы, изменение которой при переходе системы из одного состояния в другое не зависит от вида соответствующего этому переходу термодинамического процесса и определяется значениями параметров начального и конечного состояния.
(Как было отмечено выше, теплота Q и работа L представляют собой различные формы обмена внутренней энергией между ТДС и ОС. Для этих двух функций их бесконечно малое приращение в термодинамике принято обозначать оператором « », в отличие от дифференциала функций состояния, которые обозначаются оператором «d»).
», в отличие от дифференциала функций состояния, которые обозначаются оператором «d»).
Функциями состояния являются, прежде всего, известные нам параметры состояния р, v, T и внутренняя энергия U. Рассмотрим еще несколько функций состояния, имеющих широкое распространение.
Энтальпия. Наряду с внутренней энергией U в термодинамике важную роль играет величина, называемая энтальпией
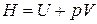 .
.
где первое слагаемое в правой части, как известно, представляет сумму кинетической энергии микрочастиц системы, второе слагаемое – потенциальную энергию взаимодействия микрочастиц системы, следовательно, левая часть составляет полную энергию.
Удельная энтальпия h =  выражается зависимостью:
выражается зависимостью:
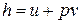 .
.
Энтропией называется функция состояния S, дифференциал которой для элементарного термодинамического процесса равен отношению бесконечно малого количества теплоты 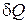 сообщаемого системе, к абсолютной температуре последней
сообщаемого системе, к абсолютной температуре последней
 .
.
Энтропия может быть определена только с точностью до аддитивной произвольной постоянной
 ,
,
S0 –константа интегрирования.
Удельная энтропия  - имеет размерность (
- имеет размерность ( ). Выразим основное соотношение, используя понятие удельной энтропии:
). Выразим основное соотношение, используя понятие удельной энтропии:
 или
или  .
.
Введение данной функции состояния значительно облегчает анализ термодинамических процессов. Физическая сущность энтропии – есть мера необратимого рассеяния энергии.
Date: 2016-02-19; view: 682; Нарушение авторских прав