
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Характеристика метода
|
|
Роданометрический метод (метод Фольгарда) объемного анализа основан на применении в качестве осадителя титрованного раствора, содержащего  :
:
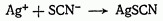
Более подробно — см. § 2.
В качестве стандартных растворов используют: для определения  — роданид аммония; для определения галогенидов и других анионов — нитрат серебра и роданид аммония.
— роданид аммония; для определения галогенидов и других анионов — нитрат серебра и роданид аммония.
Роданометрическим методом пользуются для определения галоген-ионов и серебра в серебряных сплавах.
В роданометрии в качестве индикатора для определения точки эквивалентности применяют насыщенный раствор железо-аммонийных квасцов (см. § 2).
В отличие от метода Мора, метод Фольгарда обладает рядом преимуществ.
1. Роданометрический метод применим для определения хлоридов, бромидов, иодидов, роданидов и ионов серебра.
2. Метод применим для титрования кислых растворов, так как осадок 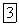 нерастворим в кислотах. Эта особенность метода делает его очень удобным при анализе серебряных сплавов, которые растворяют в кислотах, и количественном определении галогенидов в сильнокислых средах, так как галогениды в указанных средах нельзя титровать по методу Мора или в присутствии адсорбционных индикаторов.
нерастворим в кислотах. Эта особенность метода делает его очень удобным при анализе серебряных сплавов, которые растворяют в кислотах, и количественном определении галогенидов в сильнокислых средах, так как галогениды в указанных средах нельзя титровать по методу Мора или в присутствии адсорбционных индикаторов.
3. Другие ионы  и др.), мешающие определению по методу Мора, в большинстве случаев не мешают определению по методу Фольгдрда,
и др.), мешающие определению по методу Мора, в большинстве случаев не мешают определению по методу Фольгдрда,
9) Термохимические расчеты.
Основной принцип, на котором основываются все термохимические расчеты, установлен в 1840 г. русским химиком акад. Г. И. Гессом. Этот принцип, известный под названием закона Гесса и являющийся частным случаем закона сохранения энергии, можно сформулировать так:
Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
Рассмотрим пример, поясняющий закон Гесса. Раствор сульфата натрия можно приготовить из растворов серной кислоты и гидроксида натрия двумя способами:
1. Смешать раствор, содержащий два моля  , с раствором, содержащим один моль
, с раствором, содержащим один моль  .
.
2. Смешать раствор, содержащий один моль 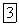 , с раствором, содержащим один моль
, с раствором, содержащим один моль  , и к полученному раствору кислой соли
, и к полученному раствору кислой соли 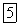 добавить раствор, содержащий еще один моль
добавить раствор, содержащий еще один моль  .
.
Запишем термохимические уравнения этих реакций.
Первый способ:
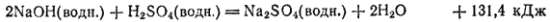
Второй способ:
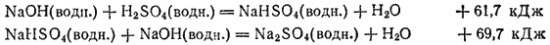
Символ (водн.) означает, что вещество взято в виде водного раствора.
Согласно закону Гесса, тепловой эффект в обоих случаях должен быть одним и тем же. Действительно, складывая тепловые эффекты, отвечающие двум стадиям второго способа, получаем тот же суммарный тепловой эффект, который наблюдается при первом способе проведения процесса: 61,7+69,7=131,4 кДж.
Таким образом, подобно обычным уравнениям химических реакций, термохимические уравнения можно складывать.
Закон Гесса дает возможность вычислять тепловые эффекты реакции в тех случаях, когда их непосредственное измерение почему-либо неосуществимо. В качестве примера такого рода расчетов рассмотрим вычисление теплоты образования оксида углерода (II) из графита и кислорода. Измерить тепловой эффект реакции
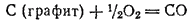
очень трудно, потому что при сгорании графита в ограниченном количестве кислорода получается не оксид углерода (II), а его смесь с диоксидом углерода. Но теплоту образования СО можно вычислить, зная его теплоту сгорания  и теплоту образования диоксида углерода
и теплоту образования диоксида углерода  .
.
Горение графита выражается термохимическим уравнением:

Для вычисления теплоты образования СО запишем эту реакцию в виде двух стадий
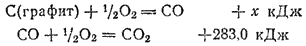
и сложим термохимические уравнения, отвечающие этим стадиям. Получим суммарное уравнение:

Согласно закону Гесса, тепловой эффект этой суммарной реакции равен тепловому эффекту реакции непосредственного сгорания графита, т. е.  . Отсюда
. Отсюда  или
или
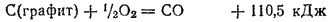
Рассмотрим еще один пример применения закона Гесса. Вычислим тепловой эффект реакции сгорания метана  , зная теплоты образования метана
, зная теплоты образования метана  ) и продуктов его сгорания — диоксида углерода (393,5
) и продуктов его сгорания — диоксида углерода (393,5  ) и воды (285,8
) и воды (285,8  ). Для вычисления запишем реакцию горения метана сначала непосредственно, а затем разбив на стадии. Соответствующие термохимические уравнения будут иметь вид:
). Для вычисления запишем реакцию горения метана сначала непосредственно, а затем разбив на стадии. Соответствующие термохимические уравнения будут иметь вид:
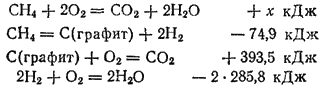
Складывая последние три термохимические уравнения, отвечающие проведению реакции по стадиям, получим суммарное уравнение горения метана:
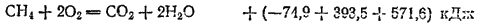
Согласно закону Гесса,  , откуда теплота сгорания метана
, откуда теплота сгорания метана  .
.
Рассмотренный пример иллюстрирует практически важное следствие закона Гесса: тепловой эффект химической реакции равен сумме теплот образования получающихся веществ за вычетом суммы теплот образования исходных веществ. Оба суммирования производятся с учетом числа молей участвующих в реакции веществ в соответствии с ее уравнением.
Date: 2015-05-22; view: 955; Нарушение авторских прав