
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Пример. 1.Определим эквивалентную массу и эквивалент кальция, если известно, что при сгорании 0,5 г этого металла образуется 0,7 г оксида
|
|
1.Определим эквивалентную массу и эквивалент кальция, если известно, что при сгорании 0,5 г этого металла образуется 0,7 г оксида.
Следовательно оксид содержит 0,5 г металла и 0,2 г кислорода, а эквивалентная масса кислорода 8 г/моль, отсюда:
0,5 г металла взаимодействует с 0,2 г кислорода,
а Мeg(X) взаимодействует c 8 г кислорода
Мeg(X) = 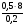 = 20 г/моль.
= 20 г/моль.
Эквивалент кальция равен 1/2 моля.
2) Способы выражения концентрации растворов и расчеты в объемном анализе
Количественный состав раствора в титриметрическом анализе выражают с помощью молярной концентрации – С.
Молярная концентрация С(В) (молярность) – содержание количества растворенного вещества (В) в одном литре раствора:
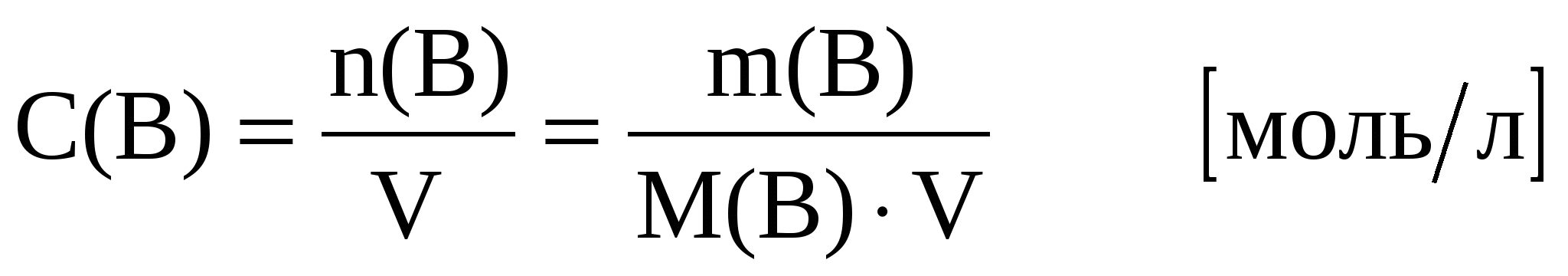
n(В)– количество вещества, моль;
m(В) – масса растворенного вещества, г;
М(В) – молярная масса вещества (В), г/моль;
V – объём раствора, л.
Для удобства расчетов в аналитической химии используют вспомогательный способ выражения состава раствора – молярную концентрацию эквивалента Сэк (нормальность) – это содержание количества вещества (В) эквивалентов в одном литре раствора:
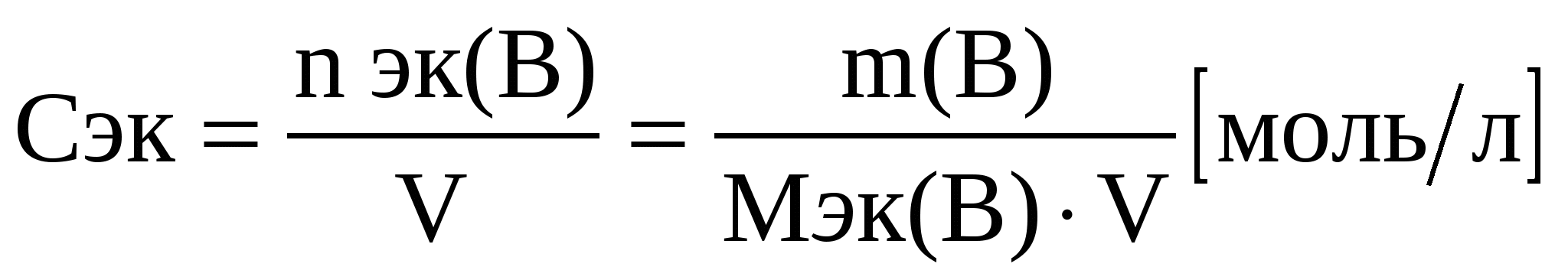
Мэк(В) – молярная массы эквивалентов вещества (В), г/моль.
Кроме того, в аналитической практике используются:
Массовая доля вещества в растворе W –массы растворенного вещества в 100 г раствора, выражается в долях или процентах:
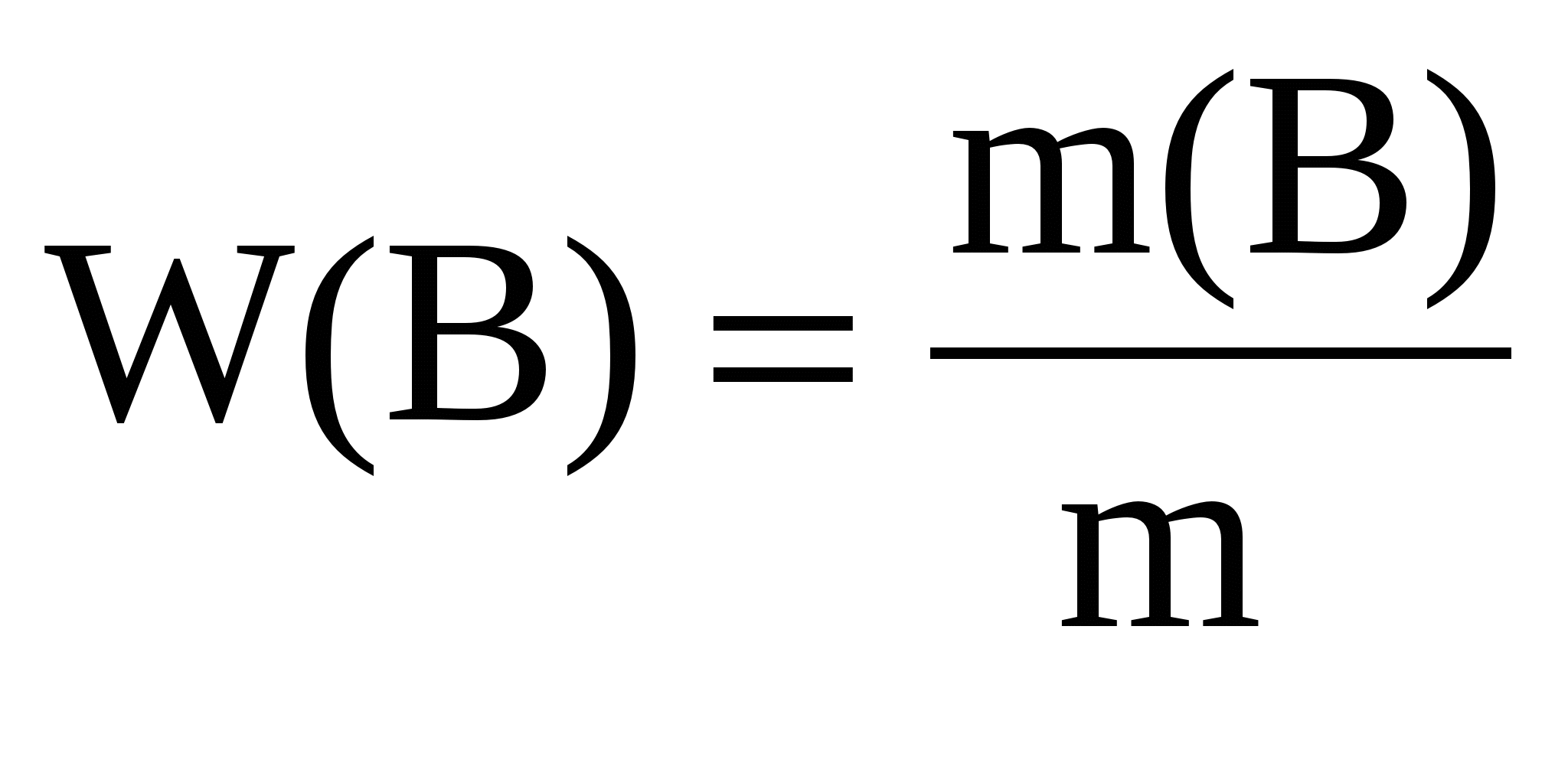
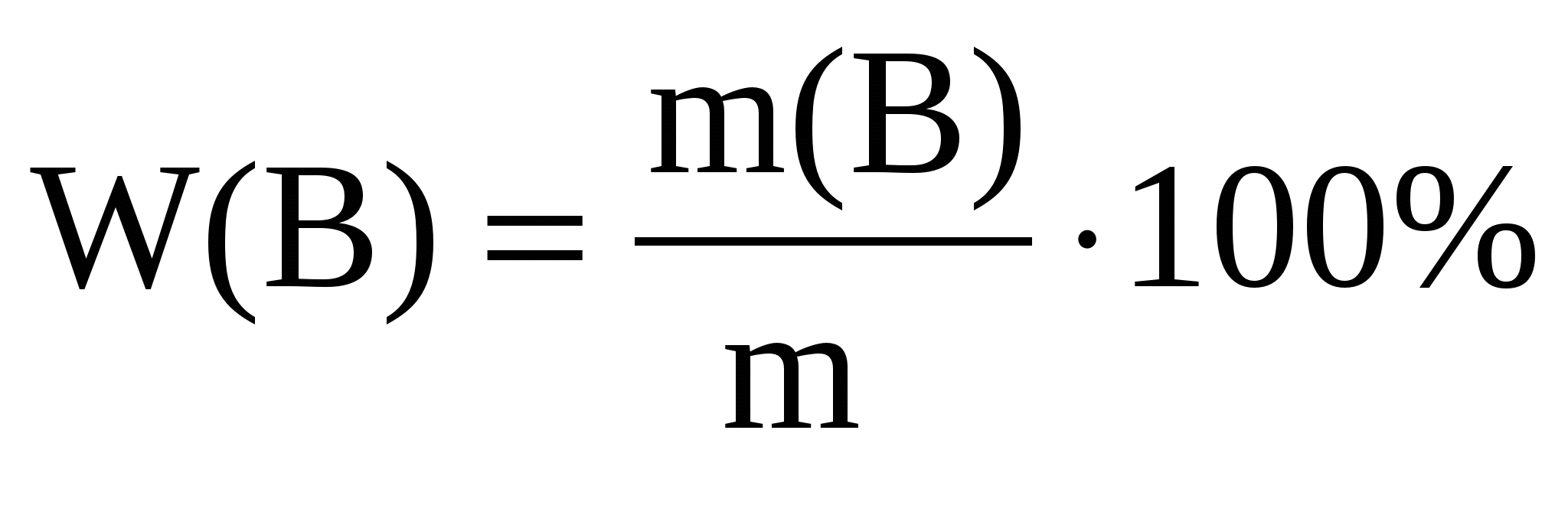
m – масса раствора, можно определить m = V∙ρ, где
V – объем раствора, мл;
ρ – плотность раствора г/мл.
Титр (T) –масса растворенного вещества (В) в одном миллилитре раствора:
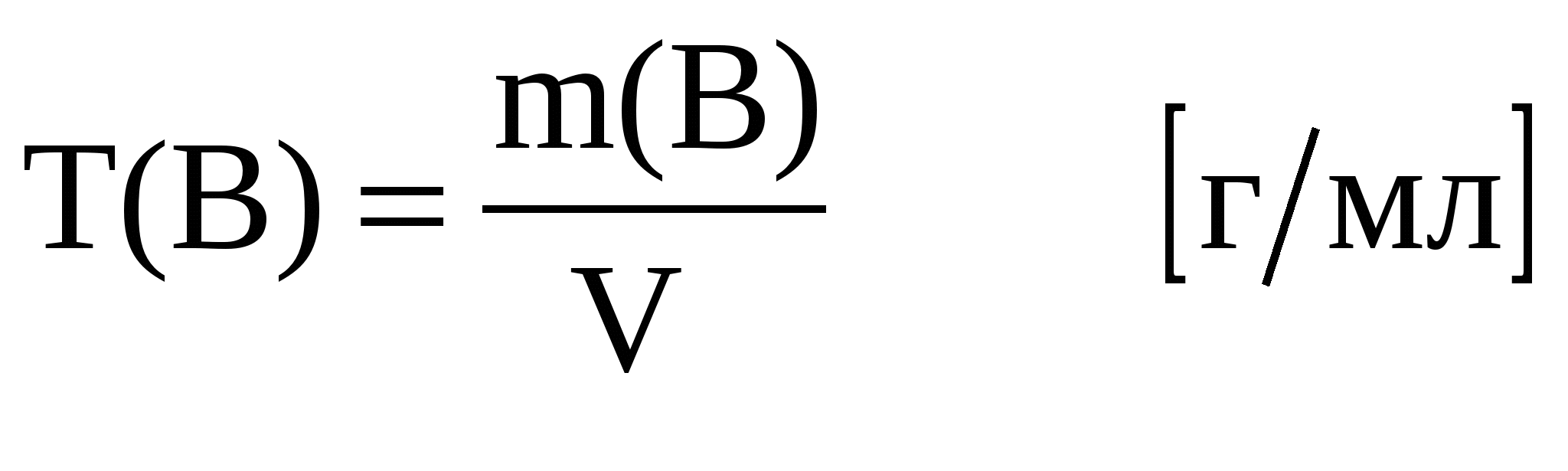
Моляльная концентрация (моляльность) Сm – содержание количества вещества (В) в одном килограмме растворителя:
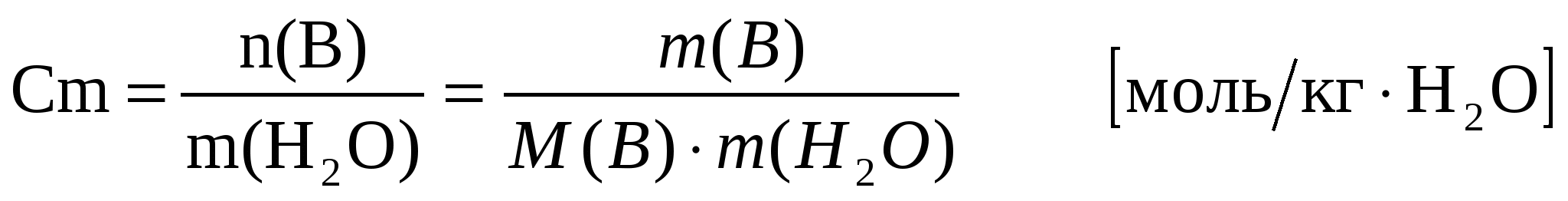
m(H2O) – масса растворителя
Мольная доля χ – содержание количества моль растворенного вещества (В) к общему количеству моль всех веществ в растворе, выражается в долях или процентах:
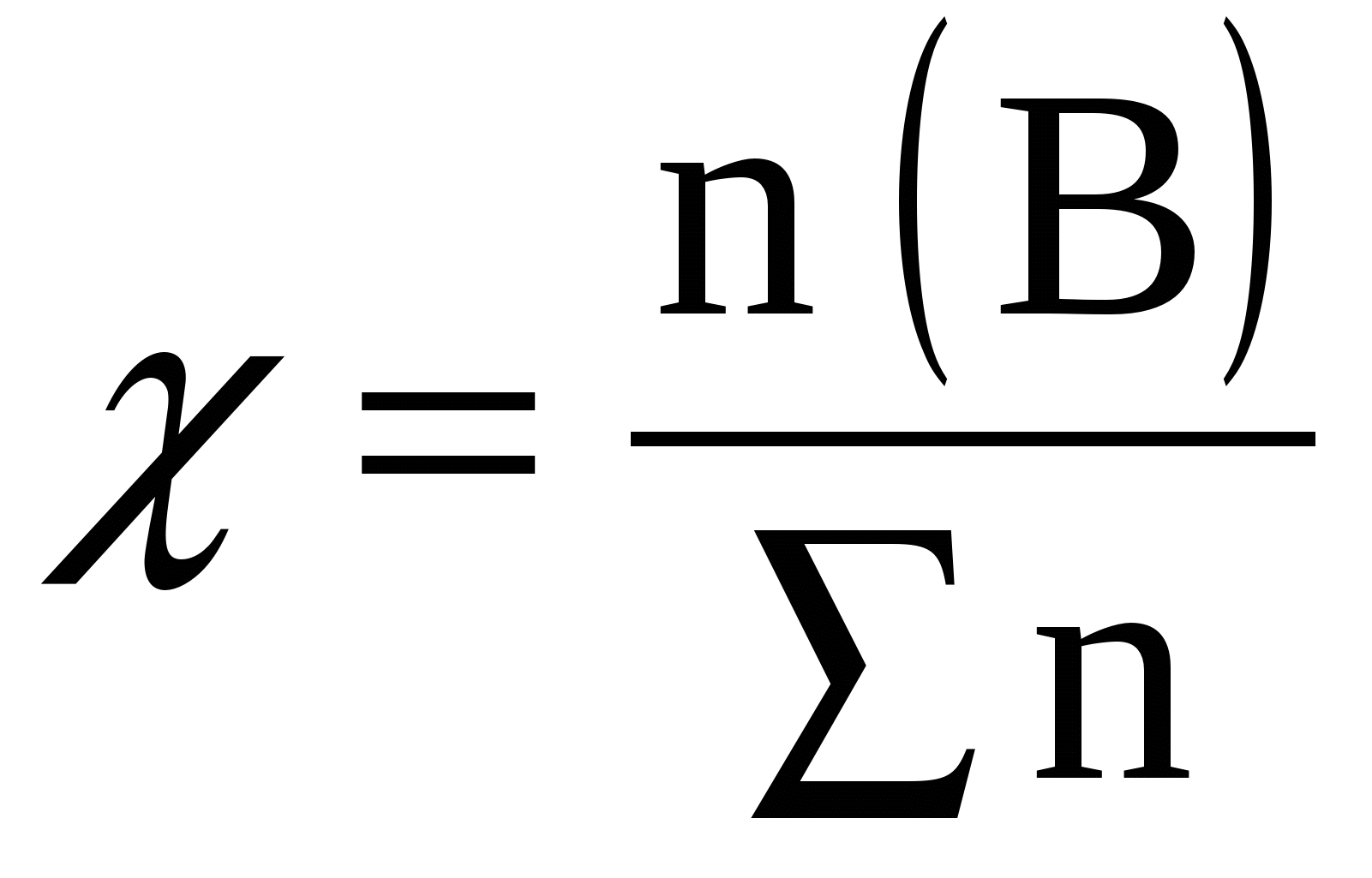
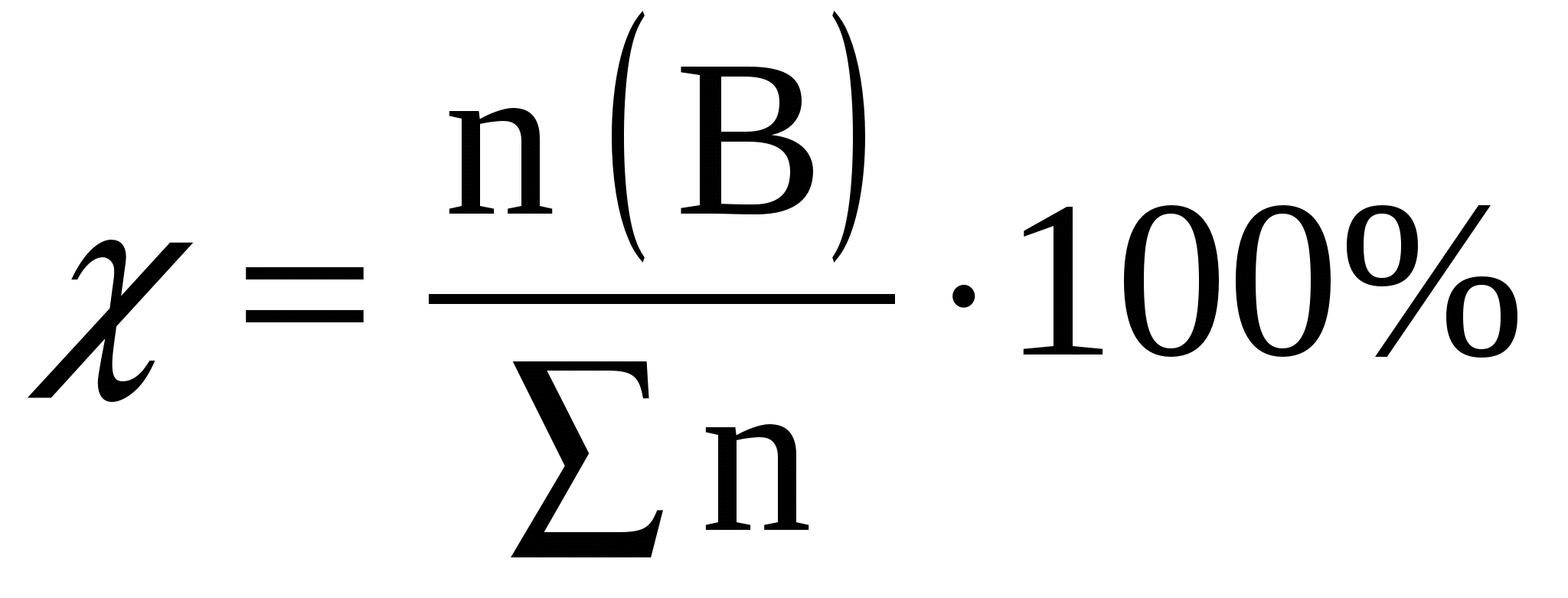
Основной закон применяемый в титриметрическом анализе – закон эквивалентов. В соответствии с законом эквивалентов – количества веществ эквивалентов реагирующих соединений равны.
Следствие из закона эквивалентов имеет вид:
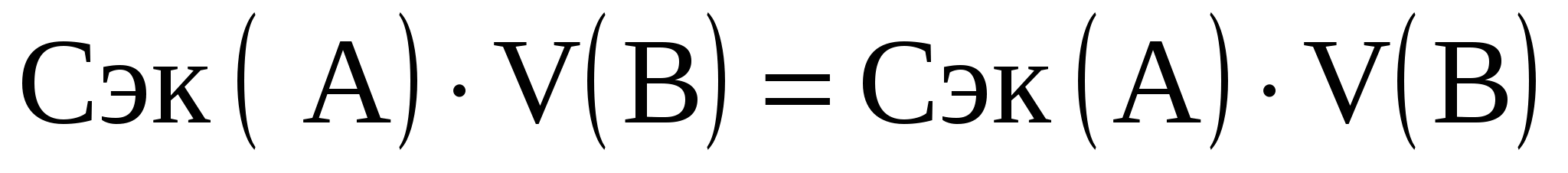 (1)
(1)
Cэк(А), Cэк(В) – молярные концентрации эквивалентов реагирующих веществ А и В, моль/л;
V(А), V(В) – объемы реагирующих веществ А и В, мл.
Date: 2015-05-22; view: 1738; Нарушение авторских прав