
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Закон Шарля
|
|
Проще говоря, если температура газа увеличивается, то и его давление тоже увеличивается, если при этом масса и объём газа остаются неизменными.Закон имеет особенно простой математический вид, если температура измеряется по абсолютной шкале, например, в градусах Кельвина. Математически закон записывают так:
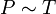 или
или 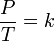
где:
P — давление газа,
T — температура газа (в градусах Кельвина),
k — константа.
Этот закон справедлив, поскольку температура является мерой средней кинетической энергии вещества. Если кинетическая энергия газа увеличивается, его частицы сталкиваются со стенками сосуда быстрее, тем самым создавая более высокое давление.
Для сравнения того же вещества при двух различных условиях, закон можно записать в виде:
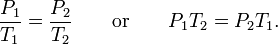
Уравнение Клапейрона-Менделеева
В уравнении (1) число молекул N можно выразить через постоянную Авогадро N = mM ⋅ NA, где m — масса газа, Μ — его молярная масса. Тогда получаем p ⋅ VT = mM ⋅ k ⋅ NA ⇒
p ⋅ V = mM ⋅ R ⋅ T. (3)
Здесь R = k ⋅ NA — универсальная газовая постоянная, равная
R = 1,38·10-23 Дж/К · 6,02·1023 моль-1 = 8,31 Дж/(моль·К).
Уравнение (3) — это тоже уравнение состояния идеального газа. В такой форме оно было впервые записано русским ученым Д.И.Менделеевым, поэтому его называют уравнением Клапейрона-Менделеева. Оно справедливо для любой массы газа и связывает между собой параметры одного состояния газа.
Законы Авогадро и Дальтона
Из уравнения состояния вытекают два следствия:
1. Из формулы (1) получим N = p ⋅ Vk ⋅ T, откуда видно, что если различные газы занимают при одинаковых температурах и одинаковых давлениях равные объемы, то число N молекул у них тоже одинаково, т.е. вытекает установленный опытным путем закон Авогадро: при равных давлениях и температурах в одинаковых объемах любых газов содержится одинаковое число молекул.
2. Пусть в сосуде имеется смесь газов, каждый из которых при отсутствии других оказывает соответственно давление p 1, p 2,... (парциальные давления газов). Запишем для каждого газа уравнение состояния:
p 1⋅ V = N 1⋅ k ⋅ T, p 2⋅ V = N 2⋅ k ⋅ T,…
и сложим их:
p 1+ p 2+…=(N 1+ N 2+…)⋅ k ⋅ TV = N ⋅ k ⋅ TV,
где N 1 + N 2 +... = N — число молекул смеси газов. Но N ⋅ k ⋅ TV = p.
Следовательно, p = p 1 + p 2 +..., т.е давление смеси газов равно сумме парциальных давлений каждого из газов — это закон Дальтона, открытый им в 1801 г. экспериментально.
Литература
1. Яворский Б.М.,Детлаф А.А. Справочник по физике
2. Исаев Д.А. Физика.,Москва,1998.
3. Жданов Л.С.,Жданов Г.Л. Физика.,Москва,1984
| Основные законы газового состояния… |
| Выполнил: Костин.А.П Преподаватель: Зинина:Е.А |
Date: 2015-05-22; view: 661; Нарушение авторских прав