
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Закон Бойля - Мариотта
|
|
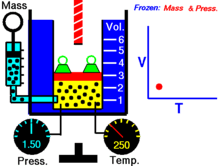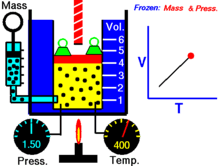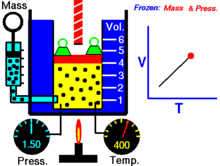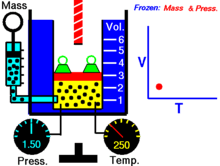
Закон устанавливает зависимость объема газа от давления при неизменной температуре. Давление замкнутой массы газа определяется высотой ртутного столбика, уравновешиваемого данной массой газа, плюс атмосферное давление.
76 см рт. ст. весит 76 · 13,6 п = 1033 п.
При постоянной температуре объем данной массы газа обратно пропорционален его давлению.
| V 1: V 2 = p 2: p 1, или pV = const, при постоянной t º, Закон Бойля - Мариотта |
(Прим) В 1662 г. открыт английским физиком Бойлем; в 1676 г. уточнен французским физиком Мариоттом.
 Для экспериментально проверки закона служит манометр (рис.167). К шкале длиной свыше 2 м прикрепляются две подвижные стеклянные трубки, связанные толстостенным резиновым шлангом. Левая трубка закрывается стеклянным краном, правая – открыта. При открытом кране ртуть в обеих трубках стоит на одинаковых уровнях. При закрытии крана в левой трубке остается некоторое количество воздуха; при подъеме правого колена манометра воздух в левом колене сжимается. Разность высот уровней ртутных столбиков, сложенная с атмосферным давлением, дает давление замкнутого воздушного столбика. Из законов Бойля – Мариотта и Гей-Люссака получается:
Для экспериментально проверки закона служит манометр (рис.167). К шкале длиной свыше 2 м прикрепляются две подвижные стеклянные трубки, связанные толстостенным резиновым шлангом. Левая трубка закрывается стеклянным краном, правая – открыта. При открытом кране ртуть в обеих трубках стоит на одинаковых уровнях. При закрытии крана в левой трубке остается некоторое количество воздуха; при подъеме правого колена манометра воздух в левом колене сжимается. Разность высот уровней ртутных столбиков, сложенная с атмосферным давлением, дает давление замкнутого воздушного столбика. Из законов Бойля – Мариотта и Гей-Люссака получается:
| p 1 V 1 / Т 1 = p 2 V 2 / Т 2 – уравнение состояния идеального газа. |
«Идеальным» называют газ, состояние которого так далеко от насыщения, что выполняются газовые законы. Если в уравнении состояния газа принять V 1 = V 2, то
p 1: p 2 = Т 1: Т 2,
Применение. Воздушный термометр Жолли (рис.168). Отсчет производится как по  манометру. Постоянный объем воздуха очень легко установить посредством впаянного в трубку стеклянного указателя. Нулевой отсчет производится при погружении колбы в тающий лед; при этом правое колено поднимается или опускается до тех пор, пока стеклянное острие не коснется мениска ртути. При погружении термометра в жидкость неизвестной температуры снова нужно установить тот же объем; при этом получают измеримое избыточное давление., которое дает возможность вычислить Т 2.
манометру. Постоянный объем воздуха очень легко установить посредством впаянного в трубку стеклянного указателя. Нулевой отсчет производится при погружении колбы в тающий лед; при этом правое колено поднимается или опускается до тех пор, пока стеклянное острие не коснется мениска ртути. При погружении термометра в жидкость неизвестной температуры снова нужно установить тот же объем; при этом получают измеримое избыточное давление., которое дает возможность вычислить Т 2.
Во всех этих измерениях необходимо к разности высот уровней ртутных столбиков прибавлять атмосферное давление.
 Гей-Люссака законы, открытые Ж. Л. Гей-Люссаком в начале 19 в. законы, описывающие некоторые свойства газов.
Гей-Люссака законы, открытые Ж. Л. Гей-Люссаком в начале 19 в. законы, описывающие некоторые свойства газов.
1) Закон теплового расширения газов утверждает, что изменение объёма данной массы газа при постоянном давлении прямо пропорционально изменению температуры
(v 2 — v 1) /v1 = aDt
или
v2 = v1 (1 + aDt),
где v1 — объём газа при исходной температуре t1; v2 — при конечной t2; Dt = t2 — t1; a — коэффициент теплового расширения газов при постоянном давлении. Величина a для всех газов при нормальных условиях приблизительно одинакова и при измерении температуры газа в °С a = 1/273,15 (или 0,00367). Сочетая этот закон с законом Бойля—Мариотта, Э. Клапейрон вывел уравнение состояния идеального газа, связывающее р, v и Т (см. Клапейрона уравнение ).
2) Закон объёмных отношений гласит, что объёмы газов, вступающих в химическую реакцию, находятся в простых отношениях друг к другу и к объёмам газообразных продуктов реакции. Другими словами, отношение объёмов, в которых газы участвуют в реакции, соответствует отношению небольших целых чисел. Измеряя при одинаковых условиях объёмы водорода, хлора и хлористого водорода, Гей-Люссак нашёл, что один объём водорода и один объём хлора, соединяясь, дают два объёма хлористого водорода, т. е. отнош ение объёмов равно 1: 1: 2. Сходная картина имеет место и при других реакциях с участием газов. Этот закон сыграл важную роль в создании атомно-молекулярной теории. Он послужил толчком для открытия Авогадро закона, с помощью которого Авогадро впервые сделал правильный вывод о составе молекул простых газов (H2, Cl2, N2 и т.д.) и строго разграничил понятия атома и молекулы. Когда молекулярные формулы всех газов точно известны, отыскание отношения объёмов газов, вступающих между собой в реакцию, уже не требует сложных измерений. Так, из уравнения синтеза хлористого водорода из водорода и хлора Н2 + Cl2 = 2HCl легко видеть, что отношение объёмов газов в этом случае равно 1: 1: 2.
Date: 2015-05-22; view: 1137; Нарушение авторских прав