
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энергия двухатомной молекулы
|
|
Рассмотрим движения, которые могут происходить внутри молекулы АВ, состоящей из двух атомов Aw. В. Во-первых, внутри молекулы имеются электроны, которые находятся в непрерывном движении. Кроме этого, атомы А и В могут колебаться относительно центра масс молекулы, а также молекула может вращаться вокруг оси, проходящей через центр масс. Каждому из этих видов движения соответствует определенное значение энергии. Таким образом, выражение для энергии молекулы Е можно записать так:
Ee + Ev + Er (22.23)
где Ее - энергия электронов; Ev - колебательная, или вибрационная энергия молекулы; ЕТ - вращательная, или ротационная энергия.
Представим себе двухатомную молекулу в виде двух частиц, соединенных пружинкой (рис. 22.7). E =
Пусть массы атомов равны m 1 и m 2, a жесткость пружинки - с. Разумеется, никаких пружинок в молекуле нет, а есть реальные силы притяжения и отталкивания, действующие между атомами. Взаимодействие атомов характеризуется зависимостью потенциальной энергии от расстояния между ними. Эту зависимость можно описать приближенной формулой (22.1), положив в ней f = 0. Это означает, что молекулу в первом приближении можно рассматривать как гармонический осциллятор.
x 1 x 2
Рис. 22.7. Модель двухатомной молекулы
Стационарное движение двух частиц вдоль проходящей через них оси х согласно представлениям квантовой механики будем описывать посредством функции
ψ = ψ (x 1, x 2),
где x 1и x 2 ~ координаты частиц. Эта функция является решением уравнения Шредингера

в котором оператор Гамильтона 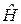 Н равен сумме операторов кинетических
Н равен сумме операторов кинетических
энергий частиц
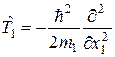
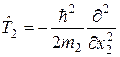
и оператора потенциальной энергии их взаимодействия
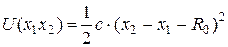
Подробнее уравнение Шредингера для двух частиц можно записать так:
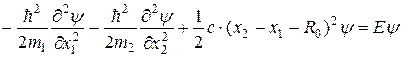
Волновая функция, описывающая движение частиц относительно их центра масс, должна зависеть только от разности координат:
ψ = ψ (ξ) (22.24)
■ где
ξ = x 2 – x 1 – R 0
Подстановка функции ψ = ψ (ξ) в уравнение Шредингера преобразует его к виду
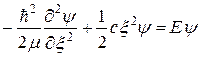 (22.25)
(22.25)
| где |

- приведенная масса молекулы. Функция (22.24), Являющаяся решением уравнения (22.25), описывает стационарное состояние гармонического осциллятора, частота колебаний которого
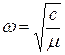
Энергия такого осциллятора принимает значения
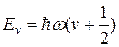 , (22.26)
, (22.26)
где колебательное квантовое число
v = 0, 1, 2,…
Энергия вращающегося тела зависит от его угловой скорости Ω согласно известной формуле
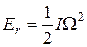 , (22.27)
, (22.27)
где I - момент инерции тела. Нетрудно доказать, что момент инерции системы двух материальных точек относительно оси, проходящей через центр масс системы, равен
I = μ 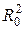 ,
,
где μ - приведенная масса, Ro~ расстояние между частицами.
Момент импульса тела прямо пропорционален его угловой скорости:
L = IΩ
При помощи этой формулы выражению (22.27) для энергии вращения можно придать вид
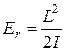 . (22.28)
. (22.28)
Значения, которые может принимать момент импульса молекулы,
можно найти по формуле
| (22.29) |
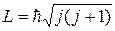 ,
,
где вращательное квантовое число
j = 0, 1, 2,...
Подстановка выражения (22.29) в формулу (22.28) дает
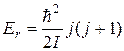
Таким образом, с учетом формул (22.26) и (22.30) для колебательной и вращательной энергий молекулы можно утверждать, что ее энергия (22.23) зависит от квантовых чисел v и j = 0,1,2,3,...
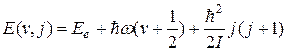 (22.31)
(22.31)
Эта формула определяет спектр энергий молекулы и расположение энергетических уровней. Причем в силу неравенства
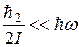
'расстояния" между вращательными уровнями, для которых число v = const, а число j принимает различные значения, меньше "расстояний" между колебательными уровнями, для которых j = 0, а число v и зменяется. В свою очередь "расстояния" между колебательными уровнями меньше "расстояний" между уровнями энергий электронов. Схема расположения уровней энергии молекулы показана на рис. 22.8.
j = 0, 1,2,3,...
j = 0, 1,2,3,...
v = const = 0 j = 0, 1, 2, 3, … v = 2 v = 1 v = 0 E Ee
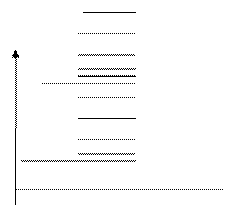
Рис. 22.8. Энергетический спектр молекулы

При переходе молекулы из одного состояния в другое она испускает или поглощает фотон. Спектр частот и электромагнитного излучения молекулы определяется формулой ħω = E 2 – E 1, где Е1 и Е2 -какие-либо два значения энергии молекулы из ее энергетического спектра (22.31).
Date: 2015-05-19; view: 1226; Нарушение авторских прав