
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Растворимость металла в электролите
|
|
Алюминий обладает свойством растворяться в электролите, что приводит к значительным потерям металла и, соответственно, снижению выхода по току.
Электросопротивление электролита в значительной мере определяет расход электроэнергии, так как составляет около ⅓ общего сопротивления электролизёра. При температуре электролиза удельное сопротивление электролита в 15 000 раз больше, чем у жидкого металла. С повышением температуры на каждые 10ºС, электросопротивление уменьшается на 2-3%. Каждый процент глинозёма в электролите увеличивает его электросопротивление примерно на 1.5%.
Фторид лития заметно повышает электропроводность. Фториды магния, кальция, глинозём, а также уменьшение КО снижают проводимость.
Вязкость. Более вязкий электролит обладает меньшей электропроводностью. Вследствие большой вязкости тормозится выравнивание концентрации составляющих в электролите, задерживается удаление пузырьков газа, в электролите вязнут капли расплавленного алюминия и частицы пены, медленнее затухают волны на границе металл-электролит, снижается выход по току. Поэтому повышенная вязкость является отрицательным свойством электролита.
Вязкость увеличивается при введении фторидов магния и кальция, а также при увеличении концентрации глинозёма, и падает при добавках фторидов натрия, алюминия, лития и при увеличении температуры.
Межфазное (поверхностное) натяжение. Находящиеся в поверхностном слое молекулы или ионы жидкости притягиваются внутренними слоями, то есть жидкость как бы стремится втянуть внутрь поверхностный слой. По этой причине вся поверхность находится в состоянии определённого натяжения, называемого поверхностным. Под действием этого натяжения жидкость стремится принять шарообразную форму, то есть иметь наименьшую площадь поверхности. Также находящиеся на поверхности жидкости молекулы и ионы притягиваются к молекулам и ионам граничащей с жидкостью среды, что существенно влияет на величину поверхностного натяжения. Поэтому, говоря о поверхностном натяжении, нужно указывать, с какой средой граничит данная жидкость, то есть справедливо говорить о межфазном натяжении.
Межфазное натяжение σ представляет собой избыток энергии в поверхностном слое на границе раздела двух фаз. Натяжение на границе металл-электролит довольно большое и сильно растёт при переходе к кислым электролитам. Это делает возможным удержание на этой границе достаточно больших количеств глинозёма, несмотря на его высокую плотность (3,54 г∕см3). На границе раздела может удерживаться кучка 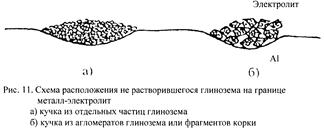 глинозёма диаметром более 3см. То есть чем больше межфазное натяжение, тем меньше выпадение осадка и образование коржей.
глинозёма диаметром более 3см. То есть чем больше межфазное натяжение, тем меньше выпадение осадка и образование коржей.
Поверхностное натяжение на границе с твёрдой поверхностью характеризуется краевым углом смачивания.
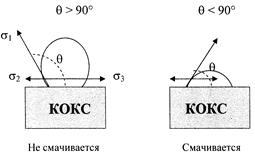 Краевые углы меньше 90° характеризуют низкое, а больше 90° - высокое поверхностное натяжение. В криолите Na3AlF6 (3NaF·AlF3) на границе расплав-твёрдая углеродистая поверхность – фтористый натрий (NaF) имеет наименьший краевой угол смачивания, то есть NaF является поверхностноактивным веществом. Этим, в частности, объясняется хорошо известная из практики избирательная способность угольной футеровки поглощать из расплава фтористый натрий (натриевое расширение).
Краевые углы меньше 90° характеризуют низкое, а больше 90° - высокое поверхностное натяжение. В криолите Na3AlF6 (3NaF·AlF3) на границе расплав-твёрдая углеродистая поверхность – фтористый натрий (NaF) имеет наименьший краевой угол смачивания, то есть NaF является поверхностноактивным веществом. Этим, в частности, объясняется хорошо известная из практики избирательная способность угольной футеровки поглощать из расплава фтористый натрий (натриевое расширение).
Сравнительно небольшая растворимость алюминия в электролите объясняется плохим смачиванием расплавленного металла электролитом. Когда это смачивание улучшается (например, при больших перегревах электролита и его науглероживании), происходит быстрое насыщение электролита металлическим алюминием – тем самым снижается выход по току.
Растворённый глинозём уменьшает краевой угол смачивания, то есть чем выше концентрация глинозёма, тем лучше электролит смачивает углеродистую поверхность (подошву анода). Уменьшение содержания глинозёма увеличивает угол, то есть на «голодных» ваннах смачиваемость электролита гораздо меньше. В системе криолит-глинозём поверхностноактивным веществом на границе с твёрдой углеродистой поверхностью является глинозём.
В системе твёрдая углеродистая поверхность-электролит-металл смачивающей жидкостью является электролит, который, проникая под металл, пропитывает угольную футеровку электролизёра. Чистый алюминий плохо смачивает угольную футеровку, но примеси железа, кремния и, особенно, натрия в алюминии значительно увеличивают его смачивающую способность. По этой причине алюминий проникает в поры и трещины футеровки, где взаимодействует с углеродом. Образование карбида алюминия Al4C3 сопровождается увеличением объёма, поэтому внутри футеровки возникают механические напряжения, разрушающие её.
С повышением температуры смачиваемость улучшается.
 Упругость пара. Работа электролизёров сопровождается заметным испарением электролита даже при минимальном его перегреве. Объясняется это, в основном, летучестью фтористого алюминия (AlF3), а также интенсивным перемешиванием электролита анодными газами. Летучесть также называют упругостью пара. AlF3, нагреваемый при атмосферном давлении, переходит из твёрдого состояния сразу в газообразное (возгоняется). В электролите AlF3 находится в связанном состоянии, поэтому испаряется не чистый AlF3, а его соединение с NaF – тетрафторалюминат натрия NaF· AlF3 (или NaAlF4). Летучесть этого соединения при 950-970°С в 5-7 раз больше летучести AlF3.
Упругость пара. Работа электролизёров сопровождается заметным испарением электролита даже при минимальном его перегреве. Объясняется это, в основном, летучестью фтористого алюминия (AlF3), а также интенсивным перемешиванием электролита анодными газами. Летучесть также называют упругостью пара. AlF3, нагреваемый при атмосферном давлении, переходит из твёрдого состояния сразу в газообразное (возгоняется). В электролите AlF3 находится в связанном состоянии, поэтому испаряется не чистый AlF3, а его соединение с NaF – тетрафторалюминат натрия NaF· AlF3 (или NaAlF4). Летучесть этого соединения при 950-970°С в 5-7 раз больше летучести AlF3.
С улетучиванием этого соединения увеличивается КО электролита, то есть электролит становится более щелочным. Для восполнения потерь от испарения и корректировки КО в электролит добавляют свежие фтористые соли (криолит, фтористый алюминий и др.).
Летучесть возрастает при понижении КО. Из практики известно, что для поддержания более низкого КО в электролизёрах, требуется больший расход фтористых солей. Потери фтора, связанные с испарением, составляют от 4 до 14 кг на тонну алюминия.
Добавки глинозёма, CaF2, MgF2, NaCl и LiF уменьшают летучесть электролита, то есть уменьшают расход фтористых солей.
Потери электролита на испарение резко возрастают с повышением температуры. При перегреве 100° потери возрастают в три раза.
Перенос вещества электролитах.Диффузия – это перенос вещества через неподвижный слой под действием разности концентраций по обеим сторонам слоя, то есть слои как бы «проникают» друг через друга. Коэффициент диффузии быстро растёт с температурой, что приводит к снижению выхода по току, так как растёт поток растворённого металла от поверхности катода вглубь расплава электролита.
Другим способом переноса вещества может служить конвекция – перемешивание слоёв вследствие бурления и циркуляции электролита.
В расплавленных солях заряженные частицы (катионы и анионы) находятся в непосредственном контакте. Из-за сил притяжения между ионами противоположного знака анионы окружены катионами и наоборот. Ионы натрия оказываются связанными с другими ионами достаточно слабо, поэтому именно они являются основными переносчиками электрического тока в электролите.
Фториды.
Как указывалось, основными составляющими электролитов являются криолит Na3AlF6 (3NaF·AlF3), фтористый алюминий (AlF3) и глинозём (Al2O3). Кроме того, для улучшения технологии в электролит искусственно вносятся или попадают вместе с сырьём фториды кальция CaF2, лития LiF и магния MgF2.
По внешнему виду криолит – порошок от бледно-розового до серовато-белого цвета с плотностью 1,1-1,2 г∕см3. Согласно ГОСТ 10561-63, искусственный технический криолит, в зависимости от содержания примесей, выпускается двух марок: К1 и К2. Наиболее распространённый способ получения криолита – кислотный из плавикового шпата. Для алюминиевой промышленности используют К1.
Фтористый алюминий (AlF3) – летучий гигроскопический порошок белого или розоватого цвета, плотностью 2,88 г∕см3, выпускается трёх сортов:
| сорт | Высший сорт | 1 сорт | 2 сорт |
| AlF3,% не менее | |||
| Al2O3,% не более | |||
| SiO2+ Fe2O3,% не более | 0,3 | 0,4 | 0,5 |
| SO42-, % не более | 0,5 | 0,7 | 1,0 |
Фтористый алюминий AlF3: (снижение КО)
• уменьшает температуру ликвидуса, что даёт возможность работать при более низкой температуре процесса;
• значительно увеличивает срок службы электролизёров из-за меньшего натриевого расширения;
• уменьшает плотность электролита, что увеличивает скорость осаждения капель алюминия и способствует скорости удаления газовых пузырьков;
• увеличивает межфазное натяжение на границе металл-электролит, что затрудняет её деформируемость, делая поверхность металла более стабильной;
• уменьшает как растворимость, так и скорость растворения глинозёма в электролите, что требует применения систем АПГ;
• уменьшает растворимость алюминия в электролите, что повышает выход по току;
• увеличивает удельное электросопротивление расплава (снижает электропроводность), что при постоянном МПР требует повышенного напряжения;
• увеличивает упругость пара электролита, что приводит к повышенным потерям фторсолей;
• увеличивает выделение газообразного фторида водорода, образующегося при взаимодействии влаги в глинозёме и воздухе с фтористым алюминием по реакции: 2AlF3+3H2O=Al2O3+6HF, что также увеличивает потери фтора и осложняет экологическую ситуацию (служит основным источником образования фтористого водорода).
Фторид кальция CaF2: (обычно от 3 до 7%)
Положительные влияния, повышающие выход по току:
• уменьшает температуру ликвидуса; • уменьшает растворимость алюминия в электролите;
• увеличивает межфазное натяжение на границе металл-электролит; • снижает упругость пара;
• смягчает корку;• способствует смачиванию частиц угольной пены, их отделению и сгоранию.
Недостатки:
• повышает плотность электролита; • уменьшает растворимость и скорость растворения глинозёма; • уменьшает электропроводность.
Сода Na2CO3.
Используется, в основном, для раскисления электролита и «размягчения» коржей.
Фторид лития LiF.
Положительные влияния:
• уменьшает температуру ликвидуса; • лучше других увеличивает электропроводность расплава;
• снижает расход анода и фторидов, а также количество их выбросов в атмосферу; • считается, что литиевые электролиты увеличивает срок службы электролизёров; • уменьшает давление паров; • уменьшает плотность.
Недостатки:
• высокая стоимость; • уменьшает растворимость и скорость растворения глинозёма;
• увеличивает содержание лития в алюминии, что требует в ряде случаев специального передела рафинирования и может вызвать осложнение при литье.
Фторид калия KF заметно увеличивает скорость растворения глинозёма в кислых электролитах.
Напряжение разложения.
Минимальное напряжение, при котором происходит электролитическое разложение вещества, называется его напряжением разложения. У глинозёма оно равно 1,3В и зависит от температуры, состава электролита, плотности тока на аноде и концентрации глинозёма в электролите.
При увеличении концентрации глинозёма в электролите с 2 до 8 %, его напряжение разложения уменьшается с 1,3 до 1,2 В.
Напряжение на ванне у нас ≈4,5 В. Разница между рабочим напряжением и напряжением разложения – это омические потери, то есть потери напряжения на преодоление электросопротивления электролита, анода и ошиновки.
| Вещество | AlF3 | NaF | MgF2 | LiF | CaF2 |
| Напряжение разложения при 1000°С, В | 3,97 | 4,37 | 4,61 | 5,11 | 5,16 |
В электролите присутствуют, в основном, катионы натрия и алюминия. Как следует из таблицы
алюминий электроположительнее натрия, поэтому первым выделяется на катоде:
| Элемент | Кальций Ca | Натрий Na | Алюминий Al | Цинк Zn | Железо Fe | Водород H | Медь Cu | Серебро Ag |
| Потенциал выделения, В | -2,76 | -2,71 | -1,69 | -0,76 | -0,44 | +0,34 | +0,80 |
Однако это не значит, что не может быть никакого выделения натрия. При обычных условиях электролиза на катоде всё же происходит разряд небольшого количества ионов натрия, причём при увеличении КО, температуры, плотности тока, вероятность этого разряда возрастает. На катоде происходит выделение более электроположительных, чем алюминий элементов Fe2+, Si2+, Cu2+ и др., если они присутствуют в электролите, ухудшая сортность алюминия и снижая выход по току.
Анодный эффект.
Периодически, при обеднении электролита глиноземом на электролизёре возникает анодный эффект: на границе анод-электролит появляется светящийся тонкий слой искровых разрядов, напряжение мгновенно возрастает порой до 70В, содержание окиси углерода (СО) в анодных газах резко увеличивается.
Анодный эффект наступает, когда концентрация глинозёма в электролите снижается до 1-1,5%, и легко устраняется при растворении в нём порции глинозёма.
Известно несколько гипотез о явлении анодного эффекта, из которых рассмотрим наиболее современную. Согласно ей развитие анодного эффекта происходит в несколько стадий:
● снижение концентрации глинозёма ведёт к уменьшению смачиваемости электролита, газовые пузырьки труднее отделяются от поверхности анода, прилипают к ней, увеличиваются в размерах, оттесняют электролит от поверхности анода.
● при этом на свободной части поверхности анода увеличивается плотность тока.
● начинается разряд ионов фтора, которые, взаимодействуя с углеродом анода, образуют газ CF4
C + 2F2 → CF4↑
кроме газообразного CF4, на подошве анода образуются твёрдые фтороуглероды, имеющие высокое электросопротивление.
● образуется газовая плёнка – электроизолятор, поднимается напряжение, пробивая плёнку путём искрового разряда.
● электрические дуги локализуются на выступах, что выравнивает подошву анода.
Гашение анодного эффекта заключается в восстановлении фтора. Восстановителями могут служить растворённый алюминий, растворённый глинозём, различные углеводороды. Таким образом, анодный эффект можно погасить перемешиванием расплава, введением жердей, погружением или качанием анода и другими методами.
Частота анодных эффектов зависит от конструкции ванны и метода питания её глинозёмом. Для ванн СОА она составляет от 0,5 до 1,5 вспышек в сутки, а для ОА и точечным питанием 0,05 - 0,5.
По напряжению вспышки делят на тусклые 10-25В и ясные (по накалу нити сигнальной лампочки – отсюда и название «вспышка») 25-50В. Напряжение анодного эффекта зависит от многих факторов, в частности, тусклые вспышки наблюдаются:
• при шероховатой поверхности анода
• при наличии «конусов» или коротких замыканий
• при большой запенённости электролита
• при высокой температуре электролиза
Анодный эффект ведёт к перерасходу электроэнергии, фтористых солей и снижению производительности электролизёров. Поэтому стремятся работать при возможно меньшей частоте вспышек. Но переход к технологии без анодных эффектов пока считают нецелесообразным, так как вспышка служит контролем хода электролизёра. Ясные, легко устраняемые вспышки – признак хорошего качества электролита и отсутствия неровностей на подошве анода, нарушающих равномерное распределение тока в электролизёре.
Анодные эффекты также подразделяются на «штатные и «нештатные».
«Штатные» анодные эффекты вызываются искусственно и призваны показать, что питание электролизера глиноземом подобрано правильно. В программе АСУТП задается время между штатными анодными эффектами, за час по истечении которого, электролизер переходит в режим «Поиск АЭ». Этот режим предназначен для того, чтобы периодически вызывать на электролизере запланированный анодный эффект. Работа режима «Поиск АЭ» заключается в полном запрещении подачи глинозема в ванну через механизмы АПГ. Алгоритм завершается при возникновении на ванне анодного эффекта, а также по истечении заданного максимального времени поиска. Сейчас достаточно методов контроля работы электролизёра, поэтому «штатные» АЭ практически не задаются.
«Нештатные» анодные эффекты возникают в любом другом режиме питания электролизера глиноземом, кроме «Поиска АЭ» и показывают, что выбранная частота питания недостаточна, либо произошла поломка системы АПГ вследствие чего необходимое количество глинозема, не попадает в электролит.
Алгоритм определения прогноза анодного эффекта работает постоянно, за исключением времени анодного эффекта и заданного периода после него. Он предназначен для предотвращения серии подач анодной рамы вниз (поддавливания ванны) непосредственно перед анодным эффектом.
Вредное действие одного анодного эффекта (длительность 2мин):
• потери металла ≈1кг, • потери фтора 1,8кг, • расход электроэнергии (Uаэ=30В) – 157кВт·ч,
• выброс фторуглерода 0,9кг, • расход углерода 0,5кг, экономический ущерб 5,2$.
Положительные влияния:
• способствует удалению угольной пены из межполюсного пространства, улучшает её отделение от электролита и сгорание,
• способствует растворению осадков на подине,
• анодный эффект с напряжением 25-45В обеспечивает «полировку» рабочей поверхности анода и, соответственно, выравнивание токораспределения на ней. При напряжениях менее 25В и свыше 45В выравнивания поверхности не происходит, а при больших напряжениях качество её ухудшается. Оптимальное напряжение анодного эффекта 30-45В.
Плотность тока, при которой начинается анодный эффект, называется критической. Её величина растёт с увеличением содержания глинозёма в электролите и температуры процесса. То есть анодный эффект возникает чаще при более низких температурах и при снижении концентрации глинозёма.
В промышленных условиях повышение частоты анодных эффектов обычно обусловлено:
• длительной работой на пониженном напряжении (из-за неправильно подобранного рабочего напряжения, отключения электролизёра от регулирования)
• снижением уровня электролита (из-за работы на пониженном напряжении, резкого снижения КО, переохлаждения ванны, пропуска выливки металла)
• некачественным гашением предыдущего анодного эффекта
• поломками АПГ
• утечками тока при замыкании ошиновки на элементы конструкции корпуса
• резким понижением температуры окружающей среды
• нарушениями в работе КПП или АСУТП (неправильное измерение тока, заниженное МПР)
Три последние причины часто приводят к увеличению частоты анодных эффектов во всём корпусе (серии).
Потери металла в электролите. Выход по току.
Расплавленный алюминий в небольших количествах растворяется в электролите. Под влиянием конвекции, растворённый металл попадает на поверхность электролита и окисляется кислородом воздуха или анодными газами по реакции:
2Al + 3CO2 → Al2O3 + 3CO
Вместе с сырьём в электролит поступают соединения, из которых некоторые элементы восстанавливаются алюминием. Например, из двуокиси кремния:
4Al + 3SiO2 → 2Al2O3 + 3Si
При определённых условиях атомы металлов могут терять не все валентные электроны и образовывать соединения низшей валентности. Алюминий, при взаимодействии с фтористым алюминием или криолитом, образует субфторид алюминия и переходит в солевую фазу:
2Al + AlF3 ↔ 3AlF
2Al + Na3AlF6 ↔ 3AlF + 3NaF
Субфторид алюминия на поверхности электролита окисляется кислородом воздуха, а под анодами двуокисью углерода:
6AlF + 3O2 ↔ 2Al2O3 + 2AlF3
3AlF + 3CO2 ↔ Al2O3 + AlF3 + 3CO
Date: 2015-05-09; view: 2549; Нарушение авторских прав