
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Процесс распада электролита на ионы называется электролитической диссоциацией
|
|
Возвращаясь к языку химических уравнений, запишем две полуреакции:
Cu2++2е=Cu
SO42--2e=SO4
Одна из них, сопровождающаяся отщеплением электронов, является окислительной, а другая, связанная с поглощением электронов, восстановительная.
Электрод, подключённый к отрицательному полюсу и на котором идёт восстановление (поглощение электронов), называется катодом. Анод – электрод, подключённый к положительному полюсу и на котором идёт окисление (отщепление электронов).
Окислительно-восстановительными называются химические реакции, в ходе которых происходит изменение степеней окисления атомов или групп атомов. Степень окисления – это формальный заряд атома в веществе. Например, для меди степень окисления +2, для алюминия +3.
В проводниках первого рода ток переносят электроны (металлы, полупроводники), в проводниках второго рода – ионы (растворы и расплавы электролитов).
Электродом называется проводник первого рода, контактирующий с проводником второго рода.
Полуреакции, протекающие на границе проводник первого рода – проводник второго рода (электролит) с участием электронов, называются электрохимическими реакциями. Эти реакции протекают на такой границе, на которой электронная проводимость электрического тока заменяется ионной проводимостью.
Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы – рекомбинировать, то есть при электролизе окислительно-восстановительная реакция может протекать в любом направлении и носить обратимый характер.
Взвешивая катод до и после опыта (см. рисунок), можно точно определить массу осадившегося металла. Измерения показывают, что масса вещества, выделившегося на электроде, зависит от силы тока и времени электролиза:
M=κ·I·t,
где М – масса вещества, претерпевшего превращение
I - сила тока, проходящего через границу раздела
t - продолжительность прохождения тока (электролиза)
κ – коэффициент пропорциональности, называемый электрохимическим эквивалентом и показывающий, какое количество вещества претерпело превращение при прохождении через границу единицы количества электричества.
| Вещество | κ в мг/Кл |
| Серебро, Ag Водород, H Углерод С Медь, Cu Цинк, Zn Алюминий, Al | 1,118 0,01045 0,299 0,3294 0,3388 0,3354 |
Первый закон Фарадея. Масса вещества, выделившегося на электроде, прямо пропорциональна заряду (количеству электричества), прошедшему через электролит (через границу).
На основании многочисленных опытов Фарадей пришёл к выводу, что электрохимический эквивалент является величиной, характерной для каждого вещества. Так, например, при электролизе раствора азотнокислого серебра AgNO3, 1 кулон (1Кл=1/3600А·час) выделяет 1,1180 мг серебра. Точно такое же количество серебра выделяется при электролизе зарядом 1 Кл любой другой серебряной соли. При электролизе соли другого металла 1Кл выделяет другое количество данного металла. Таким образом, электрохимическим эквивалентом какого-либо вещества называется масса этого вещества, выделяемая при электролизе 1 кулоном протекшего через электролит электричества.
Из таблицы видно, что эти значения электрохимических эквивалентов для некоторых веществ существенно отличаются один от другого.
Для измерения количеств веществ, участвующих в химических реакциях, выбрана особая единица – моль. Чтобы отмерить один моль вещества, нужно взять столько граммов его, какова его относительная молекулярная масса. Например, 1 моль воды (Н2О) равен 18 граммам (1+1+16=18), моль кислорода О2 – 32 грамма (16+16=32), моль железа Fe – 56 граммов, алюминия Al – 27 граммов.
Один моль NaF = 23+19 = 42г. Один моль AlF3 = 27 + 19 +19+19 = 84 г.
Особенно важно, что 1 моль любого вещества всегда содержит одинаковое число молекул.
Моль – это количество вещества, в котором содержится 6·1023 молекул этого вещества. Это число (N) называют числом Авогадро или постоянной Авогадро: N=6·1023моль-1.
Окислительно-восстановительные реакции в гальванических элементах протекают самопроизвольно, электрический ток является следствием химической реакции. При электролизе же наоборот – процесс химического превращения требует затраты электроэнергии, то есть электрический ток вызывает химическую реакцию. Поэтому справедливо определение – электролизом называется процесс химического превращения, происходящего в результате действия электрического тока.
Свойства алюминия и его сплавов
Алюминий представляет собой серебристо-белый металл с синеватым оттенком. Уникальное сочетание его свойств – малая плотность, высокая тепло- и электропроводность, коррозионная стойкость, хорошая механическая прочность в сочетании с высокой пластичностью – обеспечили широкое применение, как чистого металла, так и сплавов на его основе.
Благодаря малой плотности алюминия (2,7 г/см3), сплавы на его основе в 2 – 3 раза легче стали, хорошо поддаются механической обработке, а по прочности не уступают среднелегированным сталям. Алюминий и его сплавы хорошо противостоят атмосферной коррозии, так как покрыты тонкой (2·10-5 см), но плотной окисной плёнкой, препятствующей допуск кислорода к металлу.
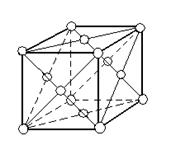 Порядковый номер Al в периодической системе Д.И. Менделеева 13, его атомная масса составляет 26,98. Al трёхвалентен и его 13 электронов расположены на оболочках: 1s2, 2s2, 2p6, 3s2, 3p1. Ядро состоит из 14 нейтронов и 13 протонов. На внешнем электронном слое находятся три валентных электрона: два на 3s-орбите и один на 3p-орбите. Поэтому в химических соединениях Al обычно трёхвалентен, но при высоких температурах устойчивы и одновалентные соединения (субсоединения).
Порядковый номер Al в периодической системе Д.И. Менделеева 13, его атомная масса составляет 26,98. Al трёхвалентен и его 13 электронов расположены на оболочках: 1s2, 2s2, 2p6, 3s2, 3p1. Ядро состоит из 14 нейтронов и 13 протонов. На внешнем электронном слое находятся три валентных электрона: два на 3s-орбите и один на 3p-орбите. Поэтому в химических соединениях Al обычно трёхвалентен, но при высоких температурах устойчивы и одновалентные соединения (субсоединения).
Кристаллическая решётка Al – гранецентрированный куб, которая устойчива при температуре от 4˚К до температуры плавления. Примеси в Al незначительно влияют на параметры решётки. Удельное электросопротивление алюминия чистотой 99,996% при температуре 20˚С составляет 2,6548·10-8 Ом·м, теплопроводность в твёрдом состоянии снижается по мере роста температуры. Температура плавления очень чувствительна к чистоте металла и для алюминия чистотой 99,996% составляет 660,3˚С, а температура начала кристаллизации 660,37˚С. Температура кипения Al около 2494˚С.
| Марка | Алюминий, не менее | Примеси, не более | ||||||
| Железо | Кремний | Медь | Цинк | Титан | Прочие | СУММА | ||
| Алюминий особой чистоты | ||||||||
| А999 | - | - | - | - | - | - | - | 0,001 |
| Алюминий высокой частоты | ||||||||
| А995 | 99,995 | 0,0015 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,005 |
| А99 | 99,99 | 0,003 | 0,003 | 0,003 | 0,003 | 0,002 | 0,001 | 0,010 |
| Алюминий технической частоты | ||||||||
| А85 | 99,85 | 0,08 | 0,06 | 0,01 | 0,02 | 0,01 | 0,02 | 0,15 |
| А8 | 99,80 | 0,12 | 0,10 | 0,01 | 0,04 | 0,02 | 0,02 | 0,20 |
| А7 | 99,70 | 0,16 | 0,16 | 0,01 | 0,04 | 0,02 | 0,02 | 0,30 |
| А7Э | 99,70 | 0,20 | 0,10 | 0,01 | 0,03 | 0,04 | 0,03 | 0,30 |
| А0 | 99,0 | 0,50 | 0,50 | 0,02 | 0,08 | 0,03 | 0,03 |
Механические свойства Al зависят от количества примесей. С увеличением их содержания пластичность уменьшается, а прочностные свойства растут. Качество Товарного алюминия регламентирует ГОСТ 11069-74, а алюминий марки А7Э, который является базовым на Лондонской бирже металлов (LME), выпускается в соответствии с ТУ-48-5-287-67. В таблице приведены выдержки из указанных стандартов, характеризующие химический состав алюминия различных марок.
Подавляющее количество алюминия используется в виде сплавов, которые, в зависимости от применения, делятся на две большие группы – деформируемые (около 80%) и литейные (около 20%).
Деформируемые сплавы предназначены для производства изделий давлением (прокатка, штамповка, волочение). Для придания изделиям определённых свойств сплавы легируют различными элементами (Cu, Mn, Si, Mg, Zn и др.). Деформируемые сплавы подразделяют на два основных класса: неупрочняемые и термически упрочняемые. Литейные сплавы используют для получения различных отливок путём литья под давлением, в кокиль, в песчаные формы, литья по выплавляемым моделям и пр.
Наибольшее распространение получили сплавы типа дуралимина, содержащие 3 -5 % Cu, 0,5 – 15 % Mg, 0,4 – 0,8 % Mn. Эти добавляемые к алюминию металлы способствуют сильному упрочнению сплава после закалки и старения. Сплавы алюминия с кремнием (4 – 13 % Si) называются силуминами. Эти лёгкие сплавы (2,6 – 2,7 г/см3) жидкотекучи, прочны и коррозионностойки. Благодаря хорошим литейным свойствам силумины используют для тонкостенного и точного литья ответственных деталей машин и приборов.
Алюминий - лидер среди конструкционных материалов в самолётостроении. Около 75% деталей изготовлено из сплавов алюминия. Армирование этих сплавов волокнами бора, бериллия или стекла придаёт конструкциям особую жесткость, позволяющую применять их для наиболее нагруженных частей сверхзвуковых самолётов.
Сплавы алюминия широко используются также в наземном и морском транспорте. Алюминиевая обшивка морских судов в десятки раз более коррозионноустойчива, чем обшивка из стали.
Тонкий слой алюминия способен надёжно предохранять от коррозии стальную конструкцию. Наносится алюминий на сталь методом горячего напыления. Суть его состоит в том, что стальная деталь обдувается струёй раскалённого инертного газа, туман из капель алюминия. Например, стальные фермы с алюминиевым напылением составляют подводную часть буровых установок для добычи нефти в море.
За последние десятилетия резко возросло применение алюминия для производства товаров широкого потребления – пылесосы, стиральные и посудомоечные машины, холодильники, вентиляторы, предметы кухонной утвари, утюги и пр. И масштабы потребления алюминия для этих целей растут постоянно.
Для производства тары, необходимой, в основном для упаковки продуктов, расходуется не только фольга, но и слоистые материалы, в качестве которых плёнки из целлофана, ацетата целлюлозы, гидрохлорида каучука, поливинилхлорида, полиэфира и полиэтилена.
Особое значение имеет применение алюминия в военной технике.
Основы электролиза криолитоглинозёмных расплавов
Электролиз криолито-глинозёмных расплавов является основным способом получения алюминия.
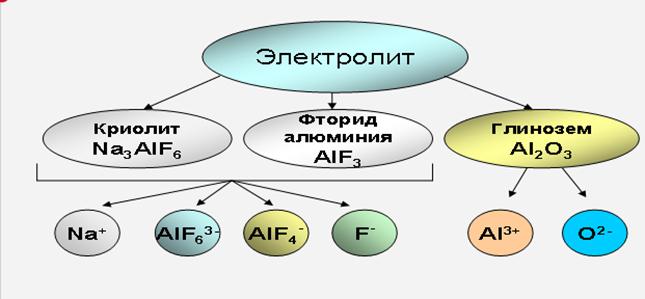
В основе электролитического производства алюминия лежит электролиз криолито-глинозёмных расплавов, основными компонентами которых являются: криолит (Na3AlF6), фтористый алюминий (AlF3) и глинозём (Al2O3).
Основной частью электролита служит криолит(Na3AlF6), который является наилучшим растворителем глинозёма(Al2O3). Различные добавки к электролиту изменяют его физико-химические свойства и влияют на технологические параметры работы электролизёра. Необходимыми добавками, используемыми в промышленности, являются фтористый алюминий AlF3 (от 2 до 14% масс) и фтористый кальций CaF2 (до 8% масс). Обе эти добавки снижают точку плавления электролита.
Температура электролита при нормальном технологическом режиме электролиза от 950˚С до 965˚С.
Основным агрегатом является электролизёр. Первые промышленные электролизёры были рассчитаны на силу тока 0,6 кА, и за последние 100 лет она возросла до 400 кА. Тем не менее, это не внесло существенных изменений в основы производственного процесса.
Существует два основных типа расходуемых угольных анодов: самообжигающиеся и предварительно обожжённые. Расплавленный алюминий при температуре электролиза (950-960°С) тяжелее электролита и находится на подине электролизёра. Криолитоглинозёмные расплавы очень агрессивны, противостоять им могут углеродистые и некоторые новые материалы. Из них и выполняется внутренняя футеровка электролизёра. Для преобразования переменного тока в постоянный применяются полупроводниковые выпрямители, установленные в кремниевой преобразовательной подстанции (КПП). Один выпрямительный агрегат даёт ток силой до 63 кА. Число их зависит от необходимой силы тока, так как все они включены параллельно.
Процесс, протекающий в электролизёре, состоит в электролитическом разложении глинозёма, растворённого в электролите. На жидком алюминиевом катоде выделяется алюминий, который периодически выливается вакуум-ковшами и отправляется в литейное отделение. На аноде происходит окисление углерода выделяющимся кислородом. Отходящий анодный газ представляет собой смесь СО2 и СО.
Глинозём, при растворении в криолите, диссоциирует на катионы Al3+ и анионы O2-.
На границе раздела алюминий-электролит протекает реакция восстановления ионов трёхвалентного алюминия.
Al3+ + 3е → Al
На угольном аноде происходит разряд кислородсодержащих ионов с образованием окислов CO и СО2
2O2-– 4e + C → CO2 ↑
или CO2+ C → 2CO ↑
Если суммировать катодные и анодные реакции, протекающие при разложении глинозёма, то процесс электролиза можно записать в таком виде:
Al2O3 + 2C → 2Al + CO2 ↑ + CO ↑
Расчёт по этой реакции позволяет найти теоретические расходные коэффициенты глинозёма 1889кг и углерода 334кг на тонну алюминия.
Таким образом, теоретически на процесс электролиза расходуется глинозём и углерод анода, а также электроэнергия, необходимая не только для осуществления электролитического процесса – 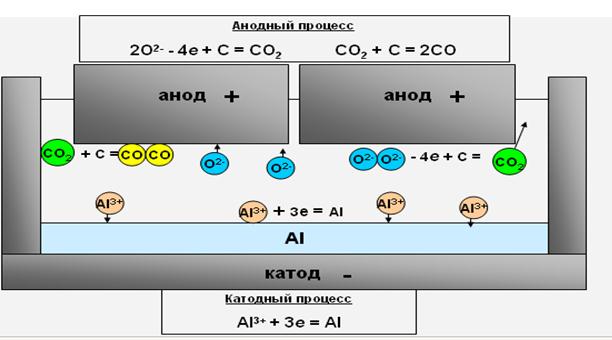 разложения глинозёма, но и для поддержания высокой рабочей температуры. Практически расходуется и некоторое количество фтористых солей, которые испаряются и впитываются в футеровку. На практике, в среднем по всем законам, для получения 1 тонны алюминия необходимо:
разложения глинозёма, но и для поддержания высокой рабочей температуры. Практически расходуется и некоторое количество фтористых солей, которые испаряются и впитываются в футеровку. На практике, в среднем по всем законам, для получения 1 тонны алюминия необходимо:
• глинозёма _______________________1925-1930 кг
• углерода анода ___________________500-600 кг
• фтористых солей __________________50-70 кг
• электроэнергии (в переменном токе) __14500 – 17500 кВт ч.
При обеднении электролита глинозёмом («голодная» ванна) возникают анодные эффекты, при которых напряжение на электролизёрах возрастает, иногда, до 70 В. Это приводит к большому выделению тепла и повышению температуры электролита, к снижению выхода по току, увеличению расхода электроэнергии и фтористых солей, поэтому задачей обслуживающего персонала является эксплуатация электролизёров без анодных эффектов.
Производство алюминия является одним из самых энергоёмких процессов, поэтому алюминиевые заводы строят вблизи источников электроэнергии.
Все материалы, поступающие на электролиз, должны иметь минимальное количество примесей.
Важные производственные характеристики процесса электролиза – это выход по току, выход по энергии и удельный расход энергии.
Масса выделившегося на катоде алюминия можно рассчитать по первому закону Фарадея: M=κ·I·t. Например, при силе тока 200 кА за 24 часа, то есть за одни сутки, теоретически мы имеем:
Mт=0,3354·200·24=1610кг∕сутки. На практике масса металла (Mп), определённая взвешиванием, всегда меньше теоретически рассчитанной, из-за неизбежных потерь на обратные реакции, «сгорание» металла.
Отношение ηт= Mп/ Mт называют выходом по току. При промышленном электролизе выход по току всвегда меньше единицы, и практически полученная масса находится по формуле:
Mп= ηт·κ·I·t.
Выход по току зависит от множества факторов и составляет от 0,82 до 0,96. Чаще выход по току выражают в процентах:
ηт= [Mп/ Mт ]·100%
Выход по энергии ηэ – это количество грамм алюминия, наработанное на ванне 1 кВт·ч электроэнергии. Зависит от выхода по току и среднего напряжения на серии:
ηэ =3,354ηт∕Uср
В зависимости от типа электролизёра, выход по энергии колеблется от 60 до 75 г∕кВт·ч.
Отношение затраченной энергии на количество произведённого металла называется удельным расходом энергии W (кВт·ч∕кг),
W= U∕κηт=U∕0,3354ηт=2,98U∕ ηт
В зависимости от типа электролизёра, удельный расход энергии составляет от 12 до 17 кВт·ч∕кг.
Расплавленный криолит (Na3AlF6), являющийся хорошим растворителем глинозёма – главный компонент электролиза. Для улучшения свойств электролита и снижения температуры его кристаллизации, а, следовательно, снижения температуры процесса и затрат электроэнергии, в расплав вводятся различные добавки. Естественно в состав электролита входит и глинозём (от 1 до 8% по массе). Для характеристики состава электролита используется понятие «криолитовое отношение» (КО). Это число молей фтористого натрия (NaF), приходящихся на один моль фтористого алюминия (AlF3). Химическую формулу криолита Na3AlF6 можно написать в другом виде:
Na3AlF6=3NaF·AlF3
Тогда легко определить КО криолита:
3NaF∕AlF3=3
Электролит с КО=3 называют нейтральным. Если электролит содержит избыток Al.01.20069ваниядств пожаротушенияик F3, то КО меньше трёх – такой электролит называют кислым. Если же КО больше 3, то есть содержится избыток NaF, то электролит щелочной. В последнее время пользуются электролитом, который содержит в своём составе порядка 15% избытка AlF3, что соответствует КО 2,3-2,5.
Электролизёр включает следующие основные блоки:
1) Катодное устройство.
2) Анодное устройство.
3) Система подвода тока (ошиновка).
4) Система газоотсоса.
Электролизёры классифицируются:
● по конструкции катодного кожуха – на кожухи с днищем и без него;
● по устройству анода – на электролизёры с самообжигающимися (СОА) и обожжёнными (ОА) анодами;
● по подводу тока к аноду – на электролизёры с боковым (БТ) и верхним (ВТ) токоподводом, к которым относятся также электролизёры ОА,
● по мощности – на электролизёры малой (до 50 кА), средней (от 50 до 100 кА), большой мощности (от 100 до 160 кА) и сверхмощные (от 160кА и более).
Из вышесказанного следует, что современные электролизёры ОА сверхмощные, с верхним токоподводом.
Электролизёры снабжены укрытиями, отводящими отходящие газы и системой очистки. Технологический процесс требует, чтобы укрытие было герметично для обеспечения газоотсоса в коллектор. В удалённых газах от электролизёров преобладает диоксид углерода, азот, кислород, газообразные и твёрдые фториды и частицы глинозёмной пыли. Для их удаления и возвращения в процесс применяются различные технологические схемы.
Современные электролизёры оборудованы системой автоматического питания глинозёмом (АПГ). Одна система пробойник-дозатор устанавливается в расчёте, приблизительно на 40 кА тока. Частота загрузки 1-2 минуты при дозе, меняющейся от 200г до 1кг. Диаметр отверстия в корке составляет около 15 см.
Электролизёры ОА, по сравнению с СОА, имеют следующие преимущества:
● Падение напряжения в аноде меньше на 50-200 мВ, по сравнению с анодами БТ и ВТ, соответственно.
● Меньше стоимость и габариты электролизёров.
● Более высокая анодная плотность тока и съём металла с единицы площади анода и катода.
● Расход анода составляет 430-475 кг на тонну алюминия (без огарков) против 515-560 кг на электролизёрах СОА.
● Меньше объём отходящих газов и отсутствие в них смолистых соединений.
● Выше качество металла.
Недостатки:
● Более высокая стоимость обожжённых анодов, чем анодной массы.
● Сложность переработки анодных огарков.
● Необходимость значительных капитальных вложений в производство обожжённых анодов.
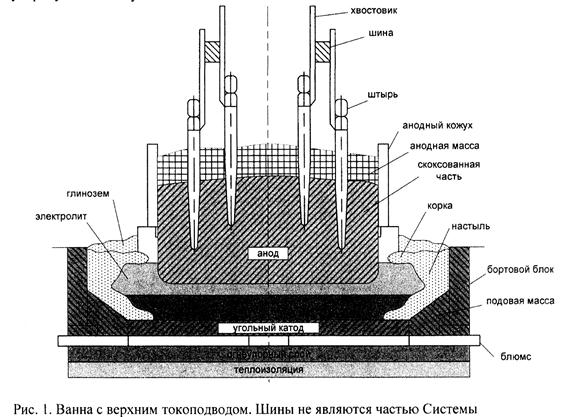
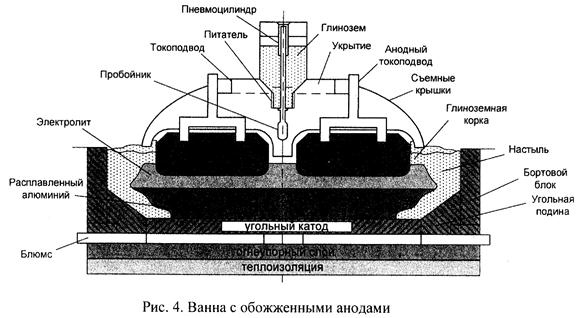
Важная особенность электролизёра – его теплоизоляция. Хорошо утеплённая подина должна исключать кристаллизацию электролита и глинозёма (появление «коржей»), которые становятся причиной многих технологических осложнений: повышение сопротивления из-за низкой проводимости твёрдого электролита и глинозёма, неравномерность тока в подине, появление горизонтальных токов в металле, вызывающих его интенсивную циркуляцию и волнение, что приводит, в конечном итоге, к снижению выхода по току.
Поскольку подовые блоки имеют пористость около 20% и эти поры заполнены электролитом, и так как солевой расплав хорошо смачивает углерод, получается, что алюминий снизу находится в некотором электролитном «чулке».
Малая теплоизоляция вдоль бортов с угольными блоками (200мм) приводит к появлению настылей, которые играют важную роль в работе ванны.
• Настыль – слой застывшего электролита на бортах электролизной ванны в зоне металла.
• Гарниссаж - слой застывшего электролита на бортах электролизной ванны в зоне электролита.
• Осадок - нерастворенная часть глинозема, которая находится на дне шахты электролизёра.
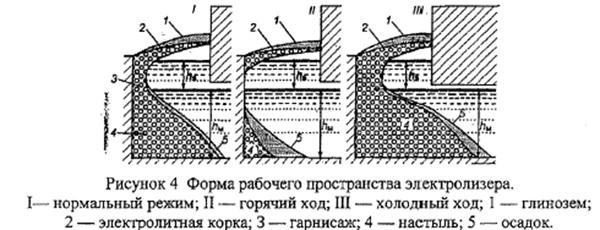
• ФРП (Форма рабочего пространства) – конфигурация застывшего электролита (гарниссажа и настыли), осадков и коржей в объеме катода электролизной ванны.
Настыль:
● Защищает блоки от разрушения (растворённый в электролите или жидкий алюминий реагирует с углеродом с образованием карбида (Al3C4), разъедая блоки и накарбиживая электролит. Настыль является надёжной защитой бортовых блоков). Подину защищает электролитический чулок.
● Служит естественным регулятором температуры электролиза. При повышении температуры настыль растворяется, увеличивается теплоотдача - температура падает. И наоборот.
● Растворение настыли или её кристаллизация – одна из главных причин изменения состава электролита. При распускании настылей КО растёт и наоборот.
● Надлежащая настыль формирует форму рабочего пространства (ФРП), которая является важнейшим показателем, характеризующим состояние технологического процесса.
Как известно, в процессе эксплуатации на периферии шахты ванны образуются настыль и гарниссаж. ФРП зависит, главным образом, от теплового состояния электролизёра. На рисунке 4 приведены разрезы ванн, работающих при разном тепловом режиме. Нормально работающий электролизёр характеризуется наличием устойчивого бортового гарнисажа, переходящего в зоне металла в крутопадающую настыль, не заходящую под анод. На «горячо» работающей ванне объём настылей значительно меньше, а корка электролита – мягче. На таких ваннах уровень металла падает. Ванны, работающие в холодном режиме, имеют мощные настыли, глубоко уходящие под анод, весьма прочную электролитную корку.
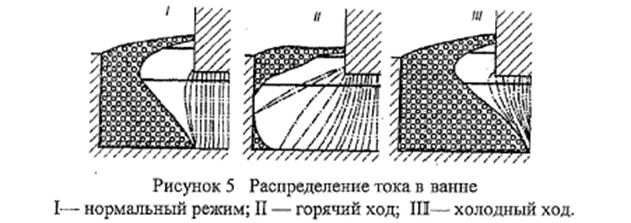 От конфигурации ФРП зависит токораспределение в ванне (рисунок 5). На «горячо» работающей ванне, катодная плотность тока меньше, чем на нормально работающем электролизёре, что приводит к уменьшению выхода по току. При холодном ходе возрастает перепад напряжения в подине из-за уменьшения её поверхности и повышения плотности тока. Кроме того, большие токи, протекающие по конструкции электролизёра и ошиновке, образуют сильное магнитное поле, зависящее от взаимного расположения токоведущих элементов. Наличие горизонтальных токов в расплаве способствует образованию электромагнитных сил, приводящих к искажению поверхности металла и возникновению циркуляции, негативно влияющих на показатели процесса, прежде всего снижению выхода по току.
От конфигурации ФРП зависит токораспределение в ванне (рисунок 5). На «горячо» работающей ванне, катодная плотность тока меньше, чем на нормально работающем электролизёре, что приводит к уменьшению выхода по току. При холодном ходе возрастает перепад напряжения в подине из-за уменьшения её поверхности и повышения плотности тока. Кроме того, большие токи, протекающие по конструкции электролизёра и ошиновке, образуют сильное магнитное поле, зависящее от взаимного расположения токоведущих элементов. Наличие горизонтальных токов в расплаве способствует образованию электромагнитных сил, приводящих к искажению поверхности металла и возникновению циркуляции, негативно влияющих на показатели процесса, прежде всего снижению выхода по току.
Одним из жёстких требований к современному электролизёру является поддержание определённого расстояния анод-катод, которое называется межполюсным расстоянием (МПР). Обычно МПР составляет 5-6 см, и каждый из них «стоит» приблизительно 350 мВ падения напряжения в электролите. При уменьшенном МПР ванну называют зажатой. Грамотный специалист понимает, что попытка необоснованно снизить МПР обязательно приведёт к усилению волнообразования (потере устойчивости), а в конечном итоге - к снижению выхода по току. Увеличение МПР, повышая выход по току, одновременно вызывает рост напряжения, и, следовательно, расход электроэнергии.
Заданная температура процесса поддерживается за счёт теплоты, выделяемой при прохождении тока через все элементы электролизёра: анод, электролит, катод. Количество теплоты определяется силой тока, одинаковой для всех электролизёров серии, рабочим электрическим напряжением на электролизёре и количеством и напряжением анодных эффектов. Рабочее напряжение на электролизёре устанавливается индивидуально, в зависимости от его технологического состояния (путём изменения МПР). Необходимо поддерживать минимальное значение рабочего напряжения, обеспечивающее нормальное протекание технологического напряжения. За счёт выполнения регламентов и функционирования системы управления электролизёром должны сокращаться до минимума количество анодных эффектов.
Для обеспечения непрерывного нормального процесса электролиза в электролизёр через систему ЦРГ и АПГ подаётся глинозём, а аноды периодически заменяются.
Требуемые значения уровня и состава электролита поддерживаются путём загрузки вторичного криолита, оборотного электролита, фтористого алюминия и фтористого кальция.
Для поддержания технологически необходимого уровня алюминия периодически проводится выливка металла из электролизёра. Вылитый алюминий сырец в ковшах отправляется для переработки в ЛП.
Если оценивать эффективность процесса по расходным коэффициентам в расчёте на тонну алюминия (энергии, глинозёма, углерода, фторидов), по себестоимости, по количеству вредных выбросов, то окажется, что перечисленные величины зависят приблизительно от 100 характеристик исходных продуктов и 30 технологических параметров, как правило, тесно связанных друг с другом. Эту связь позволяет выявить статистические методы анализа, современные компьютерные технологии, аналитические зависимости ит.п.
Традиционная технология электролиза имеет два существенных недостатка:
1) При получении алюминия расходуется дорогая электроэнергия.
2) Сам по себе электролиз имеет крайне низкий съём металла с 1м2 площади (20-30 кг в сутки) и поэтому требует больших капитальных затрат.
Эти недостатки служат причиной для постоянных разработок альтернативных способов получения алюминия.
Руды алюминия.
По содержанию в земной коре алюминий занимает первое место среди металлов (7,75%), а вместе с кислородом и кремнием составляет 82,58% массы земной коры. Он входит в состав около 250 минералов, 40% которых относятся к алюмосиликатам.
Алюминиевой рудой называют горную породу с высоким содержанием окиси алюминия в доступной для извлечения форме, образующие крупные залежи. Ниже приведены основные рудообразующие минералы алюминия, содержащие Al2O3, в %:
Диаспор, бёмит Al2O3·H2O…………………….до 85,0%
Гиббсит (гидраргиллит) Al(OH)3……………...до 65,5%
Кианит, силлиманит Al2O3·SiO2……………….до 63,0%
Каолинит Al2O3·2SiO2·2H2O……………………до 39,5%
Алунит K2SO4·Al2(SO4)3·4Al(ОН)3……………..до 37,0%
Нефелин (Na,K)2O·Al2O3·2SiO2………………...до 33,0%
Наибольшее значение для производства глинозёма имеют руды: бокситы, нефелины, алуниты, кианиты и каолины.
Боксит – сложная горная порода, состоящая из оксидов и гидроксидов Al, Fe, Si и Ti с примесями других соединений. Качество бокситов определяется содержанием в них Al2O3 и SiO2, для чего используют кремниевый модуль μSi – массовое отношение содержания Al2O3 к SiO2, то есть чем выше модуль, тем лучше качество бокситов. Разведанные запасы бокситов превышают 50 млрд тонн, что обеспечивает сырьём алюминиевую промышленность на многие годы. Самые богатые и доступные месторождения находятся в тропическом и субтропическом поясах земли. Основной особенностью этих месторождений является преобладание гиббситовых руд с высоким кремниевым модулем, небольшая глубина залегания, позволяющая вести их добычу открытым способом.
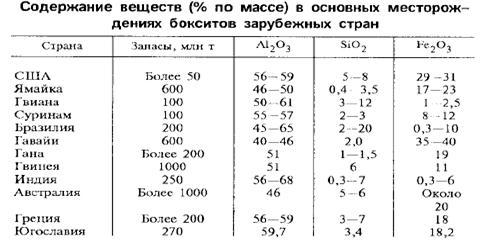
Наиболее высококачественные отечественные бокситы добываются на Урале в Северо- и Южноуральском бокситовых рудниках и перерабатываются в глинозёмных цехах Уральского и Богословского алюминиевых заводов. Они добываются в сложных горно-геологических условиях на глубине до 1 км, поэтому себестоимость их намного выше, чем за рубежом.
Разрабатываются также Тургайское месторождение бокситов (северный Казахстан – для Павлодарского алюминиевого завода), Северо-Онежское (Архангельская область – открытая добыча), Висловское (г. Белгород), Средне – Тиманское (республика Коми) и др.
Нефелиновые руды, содержащие в качестве основной составляющей нефелин, перерабатываются на Пикалевском (ПОГ), Бокштогорском (БГЗ) и Ачинском (АГК) глинозёмных заводах. При переработке, наряду с глинозёмом, получают соду, а из отходов глинозёмного производства – цемент.
Глинозём (Al2O3)
Извлечение глинозёма из алюминиевых руд является сложным химико-металлургическим процессом. Производство глинозёма осуществляется в основном двумя способами: гидрощелочным способом Байера и способом спекания. В процессе производства глинозёма производится его очистка от кремнезёма, примесей железа, титана и других компонентов. Заключительной стадией любых способов переработки является прокалка (кальцинация), в процессе которой удаляется влага и получается кондиционный глинозём.
Date: 2015-05-09; view: 3190; Нарушение авторских прав