
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Фазовые состояния и превращения воды
|
|
Сначала договоримся, что под термином "вода" будем понимать Н2О в любом из возможных ее фазовых состояний.
В природе вода может быть в трех состояниях: твердой фазе (лед, снег), жидкой фазе (вода), газообразной фазе (пар).
Рассмотрим воду без энергетического взаимодействия с окружающей средой, т.е. в равновесном состоянии.
У поверхности льда или жидкости всегда присутствует пар. Соприкасающиеся фазы находятся в термодинамическом равновесии: быстрые молекулы вылетают из жидкой фазы, преодолевая поверхностные силы, а из паровой фазы медленные молекулы переходят в жидкую фазу.
В состоянии равновесия каждой температуре соответствует определенное давление пара – полное (если над жидкостью присутствует только пар) или парциальное (если присутствует смесь пара с воздухом или другими газами). Пар, находящийся в равновесном состоянии с жидкой фазой, из которой он образовался, называется насыщенным паром, а соответствующая ему температура называется температурой насыщения, а давление – давлением насыщения.
Теперь рассмотрим неравновесные состояния воды:
а) Пусть понижается давление пара над жидкостью ниже давления насыщения. В этом случае нарушается равновесие, происходит некомпенсированный переход вещества из жидкой фазы в газообразную через поверхность раздела фаз за счет наиболее быстрых молекул.
Процесс некомпенсированного перехода вещества из жидкой фазы в газообразную называется испарением.
Процесс некомпенсированного перехода вещества из твердой фазы в газовую называется сублимациейили возгонкой.
Интенсивность испарения или сублимации возрастает при интенсивном отводе образующегося пара. При этом понижается температура жидкой фазы за счет вылета из нее молекул с наибольшей энергией. Этого можно добиться и без понижения давления, просто обдувом потока воздуха.
б) Пусть идет подвод теплоты к жидкости, находящейся в открытом сосуде. При этом температура, а соответственно и давление насыщенного пара над жидкостью растет и может достигнуть полного внешнего давления (Р=Рн).В случае, когда Р=Рн, у поверхности нагрева температура жидкости поднимается выше температуры насыщенного пара при господствующем здесь давлении, т.е. создаются условия образования пара в толще жидкости.
Процесс перехода вещества из жидкой фазы в паровую непосредственно внутри жидкости называется кипением.
Процесс зарождения пузырьков пара в толще жидкости сложен. Для кипения воды необходимо наличие центров парообразования на поверхности подвода теплоты – углубления, выступы, неровности и т.п. У поверхности нагрева, при кипении, разность температур воды и насыщенного пара при господствующем здесь давлении зависит от интенсивности подвода теплоты и может достигать десятков градусов.
Действие сил поверхностного натяжения жидкости обусловливает перегрев жидкости на поверхности раздела фаз при ее кипении на 0,3-1,5 оС по отношению к температуре насыщенного пара над ней.
Любой процесс перехода вещества из жидкой фазы в паровую называется парообразованием.
Процесс, противоположный парообразованию, т.е. некомпенсированный переход вещества из паровой фазы в жидкую, называется конденсацией.
При постоянном давлении пара конденсация происходит (как и кипение) при постоянной температуре и является результатом отвода теплоты от системы.
Процесс, противоположный сублимации, т.е. переход вещества из паровой фазы непосредственно в твердую, называется десублимацией.
Напомним, что введенные ранее понятия насыщенного пара и температуры насыщения, перенесенные на процесс кипения, объясняют равенство температур пара и жидкости при кипении. В этом случае и давление, и температура жидкой и паровой фаз одинаковы.
Жидкая фаза воды при температуре кипения называется насыщенной жидкостью.
Пар при температуре кипения (насыщения) называется сухим насыщенным паром.
Двухфазная смесь "жидкость+пар" в состоянии насыщения называется влажным насыщенным паром.
В термодинамике этот термин распространяется на двухфазные системы, в которых насыщенный пар может находиться над уровнем жидкости или представлять смесь пара с взвешенными в нем капельками жидкости. Для характеристики влажного насыщенного пара используется понятие степени сухости х, представляющее собой отношение массы сухого насыщенного пара, mс.н.п, к общей массе смеси, mсм = mс.н.п+ mж.с.н, его с жидкостью в состоянии насыщения:
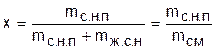 . (6.1)
. (6.1)
Отношение массы жидкой фазы воды в состоянии насыщения к массе смеси называется степенью влажности (1-х):
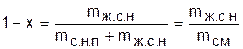 . (6.2)
. (6.2)
Подвод теплоты к влажному насыщенному пару при постоянном давлении приводит к переходу жидкой фазы смеси в паровую. При этом температура смеси (насыщения) не может быть повышена до тех пор, пока вся жидкость не будет превращена в пар. Дальнейший подвод теплоты только к паровой фазе в состоянии насыщения приводит к повышению температуры пара.
Пар с температурой выше температуры насыщения при данном давлении называется перегретым паром. Разность температур перегретого пара t и насыщенного пара того же давления tн называется степенью перегрева пара Dtп = t -tн.
С увеличением степени перегрева пара его объем растет, концентрация молекул уменьшается, по своим свойствам он приближается к газам.
6.2. Фазовые диаграммы Р,t-, Р,v- и T,s для Н2О
Для анализа различных термодинамических процессов изменения состояния H2O широкое применение находят фазовые диаграммы.
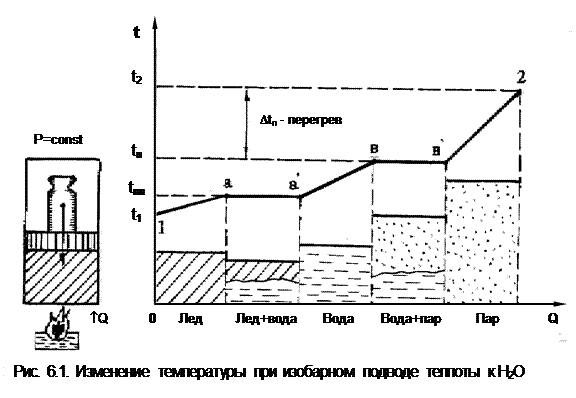
Для знакомства с фазовыми диаграммами Р,t- и Р,v представим, что в цилиндре под поршнем, создающим постоянное давление (рис.6.1), находится лед при начальной температуре t1. Через стенки цилиндра подводится теплота Q, процесс нагрева и фазовых переходов H2О показан в t,Q- диаграмме. Лед нагревается до температуры плавления tпл (процесс 1а), после чего лед плавится при постоянной температуре и превращается в воду (аа'), далее вода нагревается до температуры кипения (насыщения) tн (a'в), затем идет процесс испарения и превращения воды в сухой насыщенный пар (вв'), далее идет процесс перегрева пара (в'2) до температуры t2.
 |
Тот же процесс (12) получения перегретого пара из льда при постоянном давлении представлен на рис.6.2 в системе координат Р,t. Так как процессы плавления (aa') и парообразования (вв') протекают при постоянной температуре, на рис. 6.2 они концентрируются в точки а и в. В Р,t- диаграмме эти точки характеризуют термодинамическое равновесие двухфазных смесей. Геометрически место этих точек при различных давлениях и соответствующих им температурах представляет собой линии фазовых переходов.
Линия АВ – линия фазового перехода твердой и жидкой фаз. Это аномальная линия, т.к. для большинства веществ с ростом давления растет и температура плавления, для воды наоборот.
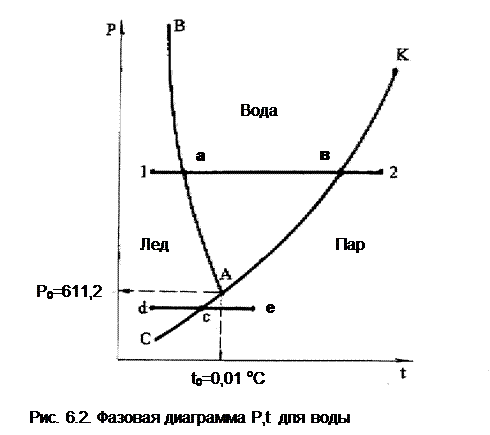 |
Линия АК – линия фазового перехода жидкой и паровой фаз, с повышением давления растет и температура кипения (насыщения) воды и пара.
С понижением давления разность температур плавления и насыщения уменьшается, и в точке А указанные кривые сходятся. Эта точка А называется тройной точкой воды; ее координаты определяют физические условия (Ро иtо), при которых все три фазы вещества находятся в термодинамическом равновесии и могут существовать одновременно. Параметры тройной точки воды: tо = 0,01 оС или 273,16 К и Ро=611,2 Па.
Кривая АС, расположенная ниже тройной точки, – линия фазового перехода и равновесия твердой и паровой фаз, т.е. линия сублимации и десублимации. Так, при давлении, соответствующем процессу de, при нагреве твердой фазы (de) в точке с происходит переход твердой фазы в пар – сублимация, при охлаждении (процесс еd) в точке c происходит переход пара в твердую фазу – десублимация. В обоих случаях переход минует жидкую фазу.
Кривыми фазовых переходов все поле Р,t- диаграммы делится на три зоны: левее линий ВАС – зона твердого состояния (лед), между кривыми ВА и КА – зона жидкости, правее КАС – зона перегретого пара. При этом линия АК вверху заканчивается точкой К, определяемой критическими параметрами. При давлениях выше критического видимого фазового перехода жидкости в пар нет.
Вода относится к веществам, имеющим несколько модификаций кристаллических фаз. В настоящее время известно шесть модификаций водяного льда. При давлениях, достигаемых в обычных технических устройствах, получается только одна модификация льда. Все остальные модификации могут быть получены при высоких давлениях. У таких веществ Р,t- диаграмма имеет не одну, а несколько тройных точек, т.к. равновесное состояние более чем трех фаз чистого вещества невозможно. Основной тройной точкой в такой диаграмме является та, в которой имеет место равновесие жидкой, газообразной и одной из твердых фаз (точка А, рис.6.2).
 |
Для веществ с нормальной закономерностью изменения объема (к ним относятся большинство веществ, встречающихся в природе, но вода к ним не относится) при постоянном давлении с увеличением температуры объем непрерывно увеличивается. У таких веществ при Р=const объем твердой фазы меньше объема жидкости, а объем жидкости меньше объема пара. В этом случае изменение объема при фазовом переходе можно представить рис. 6.3.
В точке 1 – твердая фаза с объемом v1, в точке а – твердая фаза при температуре плавления с объемом vтп, в точке а' – жидкая фаза при температуре плавления с объемом vжп, в точке в – жидкая фаза при температуре насыщения (кипения) с объемом v', в точке в' – пар с температурой насыщения с объемом v",в точке 2 – перегретый пар с объемом v2. Соотношение объемов v2>v">v'>vжп>vтп>v1, т.е. соблюдается нормальное закономерное уменьшение объема от v2 – пара до v1 – твердая фаза.
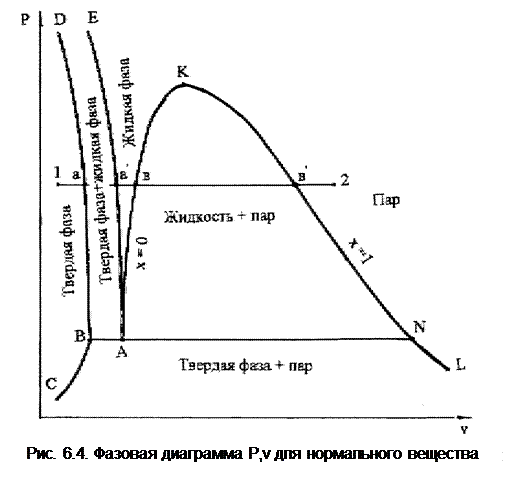 |
В соответствии с этой закономерностью можно построить фазовую диаграмму Р,v для нормального вещества (рис.6.4). Это осуществляется проведением опытов, аналогичных процессу 12 (рис.6.3) при различных постоянных давлениях, в результате чего получаются линии фазовых переходов для нормального вещества в Р,v- диаграмме (рис.6.4): DС – твердая фаза при температуре плавления; АЕ – жидкость при температуре плавления; АК – жидкость при температуре насыщения (кипения, x=0); КL – сухой насыщенный пар (x=1), ВС – твердая фаза при температуре сублимации.
Левее линии СВD – область твердого состояния; между линиями ВД и АЕ – твердая фаза + жидкость; между линиями АЕ и АК – область жидкости; между линиями АК и КN – жидкость + пар; между линиями СВ, ВN и NL – твердая фаза + пар; правее линии КL – область паровой фазы. Горизонталь ВАN соответствует тройной точке нормального вещества в Р,t- диаграмме.
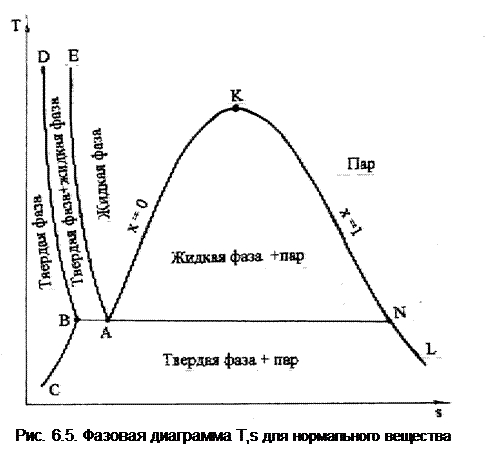 |
Аналогично диаграмме Р,v выглядит фазовая диаграмма T,s для нормального вещества (рис.6.5). Здесь левее линии DВС – твердая фаза, между линиями ВD и АЕ – двухфазное состояние, твердая фаза+жидкость, между АЕ и АК – жидкая фаза, между ВС и NL – двухфазное состояние, твердая фаза+пар; правее линии КL – перегретый пар; между АК и КN – двухфазное состояние жидкость+пар в состоянии насыщения (влажный насыщенный пар).
Эти фазовые диаграммы не могут быть распространены целиком на воду. Вода – аномальное вещество, при изобарном переходе ее из жидкого состояния в твердое удельный объем воды увеличивается (лед плавает на поверхности воды). Поэтому в Р,v- диаграмме область двухфазного состояния лед+жидкость частично накладывается на зону влажного пара и жидкости.
На рис. 6.6 изображена в укрупненном масштабе часть области фазовой диаграммы Р,v для воды в зоне перехода твердой фазы в жидкую при низких температурах. Здесь горизонталь АВN – изотерма, соответствующая тройной точке воды в Р,t- диаграмме. Вертикаль АЕ – изотерма, соответствующая температуре тройной точки для жидкости, а вертикаль ВD – та же изотерма льда. Между ними – зона двухфазного состояния жидкость+лед.
Кривая АМNL представляет линию жидкости при температуре насыщения (x=0). При повышении давления и температуры начиная со значений тройной точки воды А удельный объем кипящей воды сначала уменьшается, достигая в точке М минимума (около 4 оС и 800 Па), а при дальнейшем повышении давления и температуры удельный объем кипящей воды непрерывно растет. При температуре около 8 оС (точка N) он достигает удельного объема в точке А, и на вертикали NE совпадают две изотермы жидкости (0 и 8 оС). Аналогично этому над линией MN вертикалям будут соответствовать две изотермы жидкой фазы воды. Как указывалось ранее, жидкость плохо сжимаемая фаза, поэтому в области воды изотермы – практически вертикальные прямые линии.
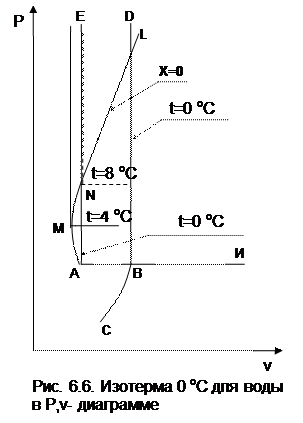 Твердая фаза воды тоже плохо сжимаемая, т.е. изотермы для льда в Р,v- диаграмме – практически прямые вертикальные линии. Кроме этого, объем твердой фазы при 0 оС близок к объему льда в состоянии плавления при температурах ниже 0 оС, а объем жидкой фазы при 0 оС близок к объему жидкости в состоянии насыщения при отрицательных температурах [13]. Зависимость изменения температуры плавления льда от давления слабо выражена по сравнению с изменением температуры насыщения от давления, так при -20 оС лед плавится при давлении 187,3 МПа, а при +20 оС вода кипит при давлении 2,33 кПа. Все вышеизложенное позволяет принять изотермы 0 оС для жидкости – линия АЕ – и льда в состоянии плавления – ВD в Р,v- диаграмме – в качестве пограничных кривых между жидкой фазой, двухфазным состоянием лед+жидкость и твердой фазой для всех давлений выше давления тройной точки воды. При этом в области температур меньше 0 оС твердая фаза будет находиться левее линии ВD, а жидкая фаза – левее линии АЕ, т.к. при уменьшении температуры уменьшается объем как жидкой, так и твердой фазы, а давление плавления льда больше давления тройной точки воды. Однако эти отклонения в пределах давлений, используемых в практике, очень незначительны.
Твердая фаза воды тоже плохо сжимаемая, т.е. изотермы для льда в Р,v- диаграмме – практически прямые вертикальные линии. Кроме этого, объем твердой фазы при 0 оС близок к объему льда в состоянии плавления при температурах ниже 0 оС, а объем жидкой фазы при 0 оС близок к объему жидкости в состоянии насыщения при отрицательных температурах [13]. Зависимость изменения температуры плавления льда от давления слабо выражена по сравнению с изменением температуры насыщения от давления, так при -20 оС лед плавится при давлении 187,3 МПа, а при +20 оС вода кипит при давлении 2,33 кПа. Все вышеизложенное позволяет принять изотермы 0 оС для жидкости – линия АЕ – и льда в состоянии плавления – ВD в Р,v- диаграмме – в качестве пограничных кривых между жидкой фазой, двухфазным состоянием лед+жидкость и твердой фазой для всех давлений выше давления тройной точки воды. При этом в области температур меньше 0 оС твердая фаза будет находиться левее линии ВD, а жидкая фаза – левее линии АЕ, т.к. при уменьшении температуры уменьшается объем как жидкой, так и твердой фазы, а давление плавления льда больше давления тройной точки воды. Однако эти отклонения в пределах давлений, используемых в практике, очень незначительны.
Линия фазового перехода льда непосредственно в пар (линия сублимации) находится при давлениях ниже давления тройной точки – линия ВС. На этой линии с уменьшением давления уменьшается температура льда и его объем. Левее линии ВС находится только твердая фаза, правее – твердая фаза+пар.

В результате фазовая диаграмма Р,v для воды имеет вид, представленный на рис. 6.7, а. Здесь левее линии СВD находится твердая фаза воды, левее линии АК – жидкая фаза воды, между линиями ЕАВD – двухфазное состояние жидкость+лед, между линиями СВNL – двухфазное состояние лед+пар, выше линии КL – перегретый пар. Благодаря аномальным свойствам воды происходит наложение областей различных фазовых состояний воды в Р,v- диаграмме: область двухфазного состояния лед+жидкость ЕАВD накладывается на область жидкости ЕАМD и на область двухфазного состояния жидкость+пар АМВА, кроме этого идет наложение и на область твердой фазы левее линии ВD. Необходимо отметить, что изображение этих областей на рис. 6.7, а выполнено для большей наглядности укрупнено, без соблюдения масштаба. В действительности объемы жидкости и льда намного меньше, чем в точках А и В, в то же время с уменьшением температуры и увеличением давления происходит уменьшение объемов этих фазовых состояний, т.е. левее линии АЕ область жидкости увеличивается по мере возрастания давления, а твердая фаза, находясь левее линии АЕ, не может располагаться левее области жидкой фазы воды при отрицательных температурах.
Для иллюстрации наложения друг на друга различных фаз воды в Р,v- диаграмме на рис. 6.7, а, б изображены две изотермы (пунктирные линии), имеющие температуру больше (t>tо) и меньше (t<tо) температуры тройной точки воды tо.
Изотерма 1234 имеет температуру меньше 0 оС и проходит в Р,v- диаграмме на линии 12 в области жидкости, на линии 22' – в области двухфазного состояния жидкость+лед, на линии 2'3 – в области льда, на линии 33' – в области двухфазного состояния лед+пар, на линии 3'4 – в области перегретого пара.
Изотерма 567 имеет температуру больше 0 оС и проходит в Р,v- диаграмме на линии 56 в области жидкости, на линии 66' – в области двухфазного состояния жидкость+пар, на линии 6'7 – в области перегретого пара.
Точки пересечения этих изотерм в Р,v- диаграмме свидетельствуют о наложении различных фазовых состояний воды друг на друга. В данных точках эти фазовые состояния имеют одинаковые удельные объемы при одинаковых значениях давлений и различных значениях температур. Так жидкость на изотерме 56 имеет одинаковый удельный объем с жидкостью+лед с одной из точек на изотерме 22', а лед на изотерме 2'3 имеет одинаковый объем с жидкостью+пар с одной из точек на изотерме 66'.
При построении фазовой T,s- диаграммы воды начало отсчета энтропии выбирают при параметрах тройной точки воды (tо=0,01 оС и Ро=611,2 Па) для жидкости в состоянии насыщения (х=0).
В дальнейшем ввиду малого отличия температуры тройной точки воды от 0 оС будет использоваться в основном значение нуля градусов Цельсия (под ним подразумевается температура тройной точки воды).
Энтропии жидкой фазы воды при температуре 0 оС для различных давлений (от давления тройной точки воды и более) будут иметь практически одинаковые численные значения, близкие к нулю. Равенство энтропий жидкой фазы воды при 0 оС и различных давлениях объясняется плохой сжимаемостью жидкой фазы воды. Поскольку энтропия, как любой параметр состояния, определяется двумя независимыми параметрами состояния, то равенству температур и удельных объемов жидкости на изотерме 0 оС будет соответствовать равенство энропий в этих точках. Отклонения численных значений энтропии в этих точках от нуля составляют тысячные доли от 1 кДж/(кг·К). Исходя из вышеизложенного изотерма жидкой фазы воды 0 оС в Т,s- диаграмме будет представлять точку А (рис.6.8, а).
Удельная теплота плавления льда – величина положительная, так при 0 оС она равна 335 кДж/кг, поэтому точка В, соответствующая твердой фазе при температуре и давлении тройной точки воды, будет находиться левее точки А, т.е. при отрицательном значении энтропии.
Аномальные свойства воды изменят характер ее фазовой диаграммы T,s по сравнению с T,s- диаграммой для нормального вещества в областях жидкого, твердого и равновесных двухфазных твердое + жидкое и твердое + пар состояний. Во-первых, эти области будут находиться ниже изотермы тройной точки воды, т.к. лед может существовать только при температурах меньше (или равных) 0 оС. Во-вторых, они будут накладываться на область сублимации, где одновременно находится твердая и паровая фазы. Жидкая фаза воды тоже может находиться при температурах меньше 0 оС, т.е. при этих температурах снова будет наложение в Т,s- диаграмме области жидкой фазы на области двухфазных состояний жидкость+лед и пар+лед.
Положительная удельная теплота плавления льда и отрицательные (в градусах Цельсия) значения температур при фазовом переходе от льда к жидкости объясняют месторасположение пограничных линий фазовых переходов: ВС – линия сублимации, АЕ – линия жидкость при температуре плавления, ВD – линия льда при температуре плавления (рис.6.8, а). Характер линий фазовых переходов в этой области объясняется зависимостью изобарной теплоемкости жидкости и льда от давления (линии с меньшей теплоемкостью в Т,s- диаграмме более крутые, чем линии с большей теплоемкостью). Линия сублимации ВС более пологая, чем линия ВД, поскольку изобарная теплоемкость льда при уменьшении давления увеличивается, а при одинаковых температурах давление на линии ВС меньше давления на линии ВД. В свою очередь линия ВД круче линии АЕ, поскольку при одинаковых температурах изобарная теплоемкость льда меньше теплоемкости жидкости.
Фазовая Т,s- диаграмма для воды будет представлена на рис. 6.8, а. Левее линии КАЕ будет находиться область жидкой фазы воды, между линиями DВАЕ – область двухфазного состояния жидкость+лед, между линиями ТоВD – область твердой фазы, между линиями СВNL – область твердой фазы+пар, выше линии КL – область перегретого пара. Область двухфазного состояния жидкость+лед DВАЕ накладывается на область двухфазного состояния лед+пар СВNL.

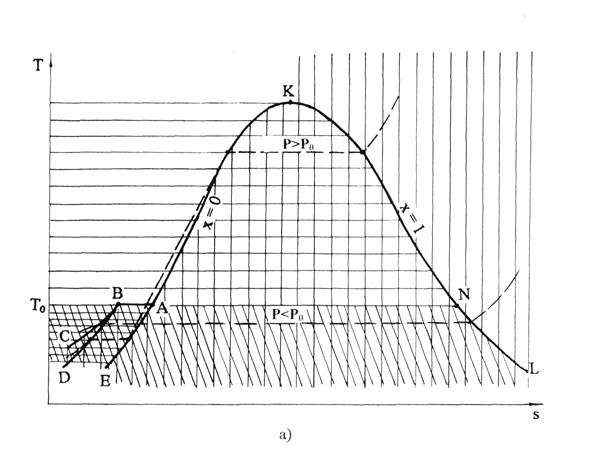
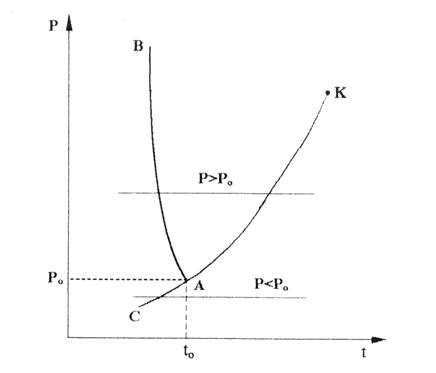
В свою очередь, на область двухфазного состояния пар+лед СВNL накладывается область льда СВD. Кроме этого на области льда и двухфазных состояний лед+пар и жидкость+лед накладывается область жидкости левее линии АЕ. На линии ВD находится область льда в состоянии плавления, на линии АЕ – жидкости при температуре плавления, на линии ВС – область сублимации, граница между льдом и паром+лед, на линии АК – область жидкости в состоянии насыщения, на линии КL – сухого насыщенного пара. Для наглядности фазовых превращений воды в Т,s- диаграмме на рис. 2.8, а пунктиром изображены изобары с давлением больше (Р>Рo) и меньше (Р<Рo), чем давление в тройной точке воды. Те же изобары показаны на рис. 6.8, б в Р,t- диаграмме.
В дальнейшем основное внимание будет уделено свойствам жидкой и паровой фаз воды при температурах больше или равных 0 оС. Поэтому в фазовых диаграммах будем изображать только эти области, т.е. практически это правая часть относительно вертикали, проведенной через точку А. В этом случае в Р,v- диаграмме изотерма 0 оC в области жидкости может рассматриваться как левая пограничная кривая жидкой фазы, т.к. она практически вертикальная прямая. В T,s- диаграмме за начало отсчета энтропии берут параметры тройной точки жидкой фазы воды. Поскольку объем жидкой фазы воды при 0 оС практически равен ее объему в тройной точке, а температура тройной точки воды очень близка к 0 оС, то постоянство этих двух параметров даст неизменное значение энтропии жидкой фазы воды при различных давлениях и t=0 oС. Таким образом, все изобары в области жидкой фазы воды будут выходить из точки А в Т,s- диаграмме.
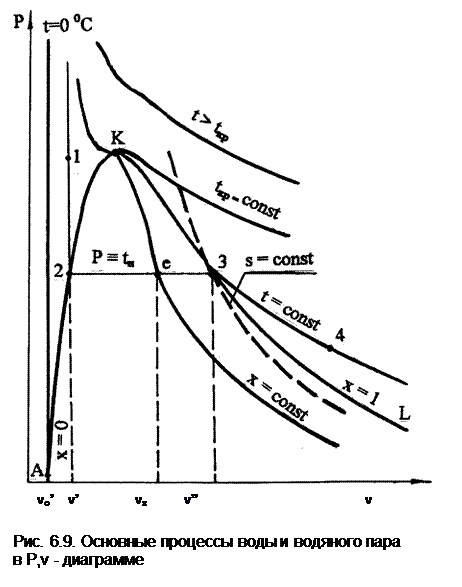
Таким образом, основные линии и процессы для жидкой и паровой фаз воды в Р,v- диаграмме могут быть представлены на рис. 6.9. Здесь докритические изотермы в области жидкости (12) близки к вертикальным прямым с незначительным смещением влево. В области влажного пара (23) изотерма совпадает с изобарой насыщения. В области перегретого пара (34) изотерма представляет кривую выпуклостью вниз. Критическая изотерма имеет точку перегиба в критической точке. Изотермы при t > tкр также могут иметь точку перегиба, которая при больших значениях температуры пропадает.
Линии постоянных энтропий представляют собой кривые выпуклостью вниз. Причем линии s < sкр пересекают только линию x = 0, а линии s > sкр пересекают только линию x = 1.
Построение линий x=const соответствует соотношению отрезков:
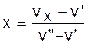 . (6.3)
. (6.3)
Удельный объем жидкости сильно отличается от удельного объема сухого насыщенного пара. Так в тройной точке воды жидкость (точка А) имеет vо'=0,00100022 м3/кг, а пар – vо"=206,175 м3/кг, в критической точке vкр=0,003147 м3/кг. При давлении 1 бар v'=0,0010434 м3/кг, а v"=1,6946 м3/кг. В результате линия x=0 более крутая, чем линия x=1.
Изображение Т,s- диаграммы для жидкой и паровой фаз воды с нанесением линий основных процессов и параметров будет дано после подробного изучения термодинамических свойств жидкой и паровой фаз воды.
 |
Date: 2015-05-09; view: 3927; Нарушение авторских прав