
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теплоемкости
|
|
Как известно[9, 12], теплоемкость реальных газов зависит от температуры и давления. Причем зависимость теплоемкости от давления проявляется в большей степени для состояний газов и паров, близких к области насыщения (см. гл. 6). Для газов и паров, состояния которых далеки от области насыщения, зависимость cpи cv от давления незначительна и при практических расчетах ею пренебрегают. Зависимость cp и cv от температуры столь существенна, что ею при точных расчетах пренебрегать нельзя.
Изменение cp и cv при изменении температуры объясняет квантовая теория теплоемкости. В отличие от кинетической теории газов квантовая теория позволяет учесть колебательное движение атомов внутри молекул двух - и многоатомных газов. Квантовая теория теплоемкости разработана Энштейном. В соответствии с этой теорией мольная изохорная теплоемкость газа представляет следующую функциональную зависимость:
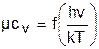 , (4.32)
, (4.32)
где h=6,6237710-27 эрг/с – постоянная Планка;
k = Rm/Nm = 1,38710-16 эрг/К – постоянная Больцмана;
n – частота колебания атомов в молекуле;
Т – абсолютная температура.
Уравнения изохорной и изобарной теплоемкостей идеальных газов с учетом влияния температуры на их значения имеют весьма сложный вид и включают в себя ряд физических констант, которые могут быть определены только экспериментально. На базе последних достижений в физике в области определения точных значений фундаментальных физических констант по спектроскопическим данным были вычислены теплоемкости многих газов (mcp и mcv) в зависимости от температуры. Данные теплоемкости занимают промежуточное положение между теплоемкостями идеальных и реальных газов, поскольку они рассчитаны на базе квантовой теории теплоемкостей идеальных газов с привлечением экспериментальных данных по константам, входящим в расчетные уравнения этих теплоемкостей.
Область практического применения этих теплоемкостей ограничена. Однако для газов и их смесей, широко используемых в практике (воздух, азот, кислород, водород, окись и двуокись углерода, гелий, продукты сгорания органического топлива и т.п.) в большом диапазоне температур и давлений справедливо уравнение Pv=RT, следовательно, в расчетах процессов этих газов можно использовать значения теплоемкостей идеальных газов cp и cv, рассчитанных по квантовой теории теплоемкостей. В свою очередь, используя значения этих теплоемкостей, можно рассчитать энергетические параметры газов. Так в литературе [12] значения теплоемкостей и производных от них энергетических параметров, приведенные в таблицах, дают погрешность не более 0,5 % по сравнению с экспериментальными значениями тех же величин для давлений до 3 МПа и температур от -50 до +1500 оС. Такой диапазон изменения параметров позволяет рассчитать большинство газовых процессов, проходящих в промышленном и энергетическом оборудовании.
Date: 2015-05-09; view: 831; Нарушение авторских прав