
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энергетические свойства реальных газов
|
|
Получение уравнения состояния реального газа, достаточно точно описывающего его термодинамические свойства, очень важная задача. Термические уравнения состояния используются не только для расчета термических параметров и их изменений, но и для определения энергетических (калорических) величин (u, h, s, cp, cv и т.п.) с помощью дифференциальных уравнений термодинамики.
Одним из первых попытку получить уравнение состояния, описывающее свойства вещества в газообразном и жидком видах, предпринял в 1887 году голландский ученый Ван-дер-Ваальс [10]. Основываясь на логических рассуждениях, он составил уравнение
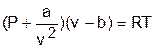 , (5.1)
, (5.1)
где a и b – постоянные величины, так же как и R, характеризующие индивидуальные свойства вещества.
Уравнение Ван-дер-Ваальса отличается от уравнения Клапейрона тем, что вместо давления Р в нем фигурирует сумма (Р + a/v2), а вместо объема v стоит разность (v - b).
Ван-дер-Ваальс на основании простейших молекулярно-кинетических соображений показал, что силы взаимного притяжения молекул обратно пропорциональны квадрату удельного объема v, следовательно, слагаемым a/v2 учитывается взаимодействие молекул газа. Из физики известно, что силы взаимного притяжения молекул приводят к появлению внутреннего давления в газах и жидкостях, следовательно, величину a/v2 можно рассматривать как внутреннее давление газа.
Согласно уравнению Клапейрона для изотермического процесса при Р®µ v®0. Из уравнения Ван-дер-Ваальса следует, что при давлении Р®µ удельный объем v®b, следовательно, величину b можно рассматривать как объем, занимаемый собственно молекулами.
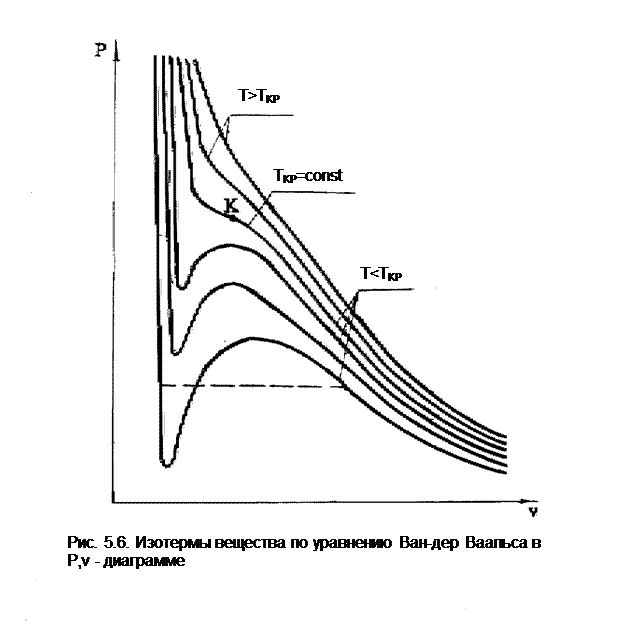 |
Величины a и b могут определяться экспериментально, но можно их и рассчитать. По расчетам получается, что они зависят от параметров критической точки газа, поэтому газ, подчиняющийся уравнению (5.1), называют ван-дер-ваальсовским газом. Изотермы Ван-дер-Ваальса в Р,v- диаграмме изображены на рис. 5.6. Сверхкритические изотермы качественно соответствуют изотермам реального газа. Докритические изотермы вместо горизонтального участка, характеризующего фазовый переход жидкость-пар, имеют волнообразный участок.
Как показывают расчеты, попытки применения этого уравнения для описания областей, где вещество обладает резко выраженными свойствами реального газа (вблизи линии насыщения и околокритическая область), и тем более области жидкости, приводят к большим отклонениям от реальных значений параметров веществ. Поэтому практическое применение уравнение Ван-дер-Ваальса может найти только в ограниченной области состояний реальных газов [1, 2]. Ценность этого уравнения заключается в возможности качественной оценки и наглядной иллюстрации влияния простейших признаков реального газа на его термодинамические свойства.
В целях усовершенствования уравнения Ван-дер-Ваальса в него вводились поправки. В результате учеными был получен ряд новых уравнений состояния реальных газов. Некоторые из них довольно точно описывали экспериментальные данные и были использованы для составления таблиц термодинамических свойств ряда веществ.
Значительный шаг в направлении создания уравнения состояния реального газа был сделан американским физиком Дж. Майером и советским математиком Н.Н.Боголюбовым в 1937–48 гг. [10]. Независимо друг от друга они методом статистической физики показали, что в наиболее общем виде уравнение реального газа выглядит следующим образом:
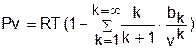 , (5.2)
, (5.2)
где bk – вириальные коэффициенты, являющиеся функцией только температуры.
Вириальные коэффициенты этого уравнения не могут быть вычислены теоретическими методами и должны определяться с помощью эксперимента. Эта задача оказывается чрезвычайно сложной, и более целесообразным является получение уравнения в виде аппроксимированной функции взаимосвязи параметров, определенных на основании экспериментальных и расчетных данных.
Следовательно, описание термодинамических свойств веществ может идти различным образом, в зависимости от подчиненности его физических свойств определенной закономерности.
В практике получили широкое распространение таблицы термодинамических свойств веществ и построенные на их базе диаграммы зависимостей параметров состояния. В этих таблицах зависимость термических параметров состояния, как правило, определяется экспериментально. На базе этих зависимостей с использованием дифференциальных уравнений термодинамики рассчитывают значения энергетических величин h, u, s и cp. Многие из этих величин могут быть получены и экспериментально, при этом можно, определив одну, рассчитать другую, например, по сp рассчитать h, s и т.д.
Для координации работы в области определения термодинамических свойств веществ и установления единых расчетных норм осуществляется международное сотрудничество.
Подробно остановимся на термодинамических свойствах воды и водяного пара. Вода и водяной пар широко используются в быту, в теплоэнергетических, теплоиспользующих и других установках. Поэтому исследованию их свойств уделяется особое внимание. Однако вода является рядовым веществом, и принципиально все, что относится к воде во всех ее фазовых состояниях, может быть распространено на другие вещества. Для других веществ отличными от воды являются численные значения их теплофизических величин, и, кроме того, вода имеет некоторые аномальные свойства, на которые будет особо указываться.
Date: 2015-05-09; view: 1212; Нарушение авторских прав