
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глава 8. Водородный показатель. Гидролиз солей
|
|
После изучения этой темы вы должны:
- иметь представление о следующих понятиях и величинах: ионное произведение воды, водородный показатель рН, гидролиз солей.
- освоить методы расчета значений рН для растворов кислот и оснований по их концентрациям и, наоборот, расчет концентраций по известному значению рН.
- уметь определять характер среды в водных растворах электролитов.
Вода – слабый электролит, диссоциирующий на катион водорода и анион гидроксила.
Н2О Û Н++ОН-. Константа диссоциации воды:
ß
Кд = 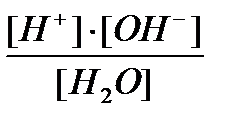 = 1,8.10-16; так как диссоциирует ничтожная часть молекул воды, то [H2O]~ постоянная величина, Кд.[H2O] = const = KH2O;
= 1,8.10-16; так как диссоциирует ничтожная часть молекул воды, то [H2O]~ постоянная величина, Кд.[H2O] = const = KH2O;
KH2O = [H+].[OH-] = 10-14, (при 250С). Эту величину называют - ионным произведением воды.
В разбавленных растворах электролитов (солей, кислот, щелочей) KH2O- постоянная величина. Зная [H+]., можно вычислять .[OH-] и наоборот.
При [H+] = [OH-]=10-7моль/л- среда нейтральная
При [H+] > [OH-], [H+]>10-7моль/л- среда кислая
При [H+] < [OH-], [H+]<10-7моль/л- среда щелочная.
Для характеристики среды раствора используют водородный показатель рН.
pН= -lg[H+], где [H+]-концентрация, моль/л
[H+] 100 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10-10-11 10-12 10-13 10-14
моль/л увеличение кислотности увеличение щелочности
ß à
рН 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
рН < 7 кислая среда рН = 7 нейтральная среда рН > 7 щелочная среда
Определить рН можно с помощью индикаторов (табл. 10).
Таблица 10
Цвет универсального индикатора в зависимости от рН
| рН | 1-3 | 4,5 | 9,10 | 11-13 | |||
| Цвет | красный | оранжевый | желтый | зеленый | бирюзовый | голубой | фиолетовый |
Зная концентрацию одного из ионов воды в растворе, всегда можно вычислить концентрацию другого иона, исходя из ионного произведения воды.
Date: 2015-05-09; view: 799; Нарушение авторских прав