
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глава 9. Коллигативные свойства растворов
|
|
После изучения этой темы вы должны:
иметь представления о следующих понятиях и явлениях:
- осмос, осмотическое давление (закон Вант-Гоффа), его роль.
- закон Рауля о давлении паров растворителя над раствором и изменении температур кипения и замерзания растворов (следствия закона Рауля).
Коллигативные свойства – это свойства, которые не зависят от природы частиц растворенного вещества, а зависят только от концентрации частиц в растворе. Коллигативными свойствами разбавленных растворов являются:
- скорость диффузии
- осмотическое давление (Закон Вант-Гоффа)
- давление насыщенного пара растворителя над раствором (Закон Рауля)
- температура кипения раствора (1следствие из закона Рауля)
- температура кристаллизации раствора (2 следствие из закона Рауля)
Свойства неэлектролитов
Осмосом называется самопроизвольное перемещение молекул растворителя через полупроницаемую мембрану из раствора меньшей концентрации в раствор большей концентрации. В результате протекания осмоса возникает осмотическое давление раствора. Гипертоническим раствором называют тот раствор, у которого осмотическое давление больше. Гипотоническим раствором – раствор с меньшим осмотическим давлением. Изотоничные растворы – это растворы с одинаковой величиной осмотического давления.
| Растительная клетка (С >) (внутриклеточный раствор) |
| Мем-брана |
| Внешняя среда (С <) (межклеточный раствор) |
Н2О Н2О
Вант-Гофф, изучая зависимость осмотического давления от внешних факторов установил, что оно не зависит от природы растворенного вещества, а зависит только от числа частиц в растворе и от температуры:
Росм= СмRT, где Росм [кПа], T [K]- абсолютная температура, R=8,32 кДж/моль - универсальная газовая постоянная, См - молярная концентрация раствора [моль/л].
Осмотическое давление раствора, содержащего несколько веществ, равно сумме осмотических давлений, вызываемых каждым из них.
Давление насыщенного пара растворителя над раствором (Закон Рауля):
Относительное понижение давления насыщенного пара над раствором прямо пропорционально мольной доле растворенного вещества: 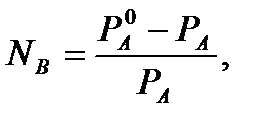 где
где 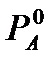 -давление насыщенного пара над чистым растворителем; РА-давление насыщенного пара растворителя над раствором; NB- мольная доля растворенного вещества:
-давление насыщенного пара над чистым растворителем; РА-давление насыщенного пара растворителя над раствором; NB- мольная доля растворенного вещества: 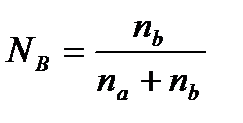 , где na, nb – число молей растворителя (а) и растворенного вещества (b).
, где na, nb – число молей растворителя (а) и растворенного вещества (b).
Набольшее практическое значение получили I, II следствие закона Рауля.
I следствие закона Рауля: Повышение температуры кипения раствора прямо пропорционально молярной концентрации растворенного вещества: Dtкип = Kэб.Сm, где Dtкип = t кип р-ра – t кип н2o, 0С; Kэб – эбулиоскопическая константа растворителя (Kэб н2о); Сm- моляльная концентрация растворенного вещества, моль/1000г растворителя.
II следствие закона Рауля: Понижение температуры замерзания раствора прямо пропорционально молярной концентрации растворенного вещества: Dtзам =Kкр.Сm, где Dt= t зам.н2о – t зам р-ра, 0С; Kкр - криоскопическая константа растворителя (Ккр н2о =1,86); Сm- моляльная концентрация растворенного вещества, моль/1000г растворителя.
| Росм = См R T Dtкип = Кэб Cm Dtзам = Ккр Cm | ß | Коллигативные свойства для молекулярных растворов |
Примечание: см. приложение 7 – «Криоскопические константы некоторых растворителей», приложение 8 – «Эбулиоскопические константы некоторых растворителей».
Эти уравнения справедливы только для растворов, в которых отсутствует взаимодействие частиц, т.е. для идеальных растворов. В реальных растворах имеют место межмолекулярные взаимодействия между молекулами вещества и растворителя, которые могут приводить либо к процессам диссоциации, либо к процессам ассоциации молекул. Диссоциация молекул вещества в водном растворе характерна для сильных электролитов. В результате диссоциации число частиц увеличивается.
Доля (i) образовавшихся частиц определяется как отношение общего числа частиц к первоначальному числу молекул. Она зависит от степени диссоциации электролита и от числа частиц, на которые распадается молекула:
i = (n -1)a + 1, i – получил название изотонический коэффициент, n – число частиц (ионов), на которые распадается молекула, a – степень диссоциации (в долях).
| Росм = iСМ R Т Dt кип = i Кэб Сm Dtзам = i Ккр Сm | ß | Коллигативные свойства для растворов электролитов |
Примеры расчетов температур кипения, замерзания, осмотического давления растворов различных концентраций
Пример 1. Вычислить температуру замерзания, кипения раствора этилового спирта с процентной концентрацией (w), равной 40 %.
Решение: Вычислим температуру замерзания раствора исходя из II следствия закона Рауля: Dtзам = Kкр.Сm, однако для решения необходимо перейти от одного вида концентрации к другому:
w [m в-ва, г \ 100г р-ра] ® Сm[ n молей \ 1000 г р-ля ]
1. Перейдем от массы вещ-ва (m) к молям (n) через пропорцию:
1 моль С2Н5ОН содержит ------- 46 г
х моль //------//-------//-------//------40 г
или по формуле х(n) = 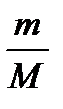 =
= 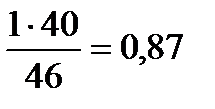 моль/100р-ра,
моль/100р-ра,
где m(с2н5он) = 40г, M(с2н5он) = 46г/моль
2. Перейдем от массы раствора к массе растворителя:
m р-ля = m р-ра - m в-ва = 100 – 40 = 60г р-ля
2. Через пропорцию выразим Сm:
0,87 молей С2Н5ОН содержит в 60 г растворителя
х (Сm) -//-----//-----//-----//------/- 1000 г
х (Сm) = 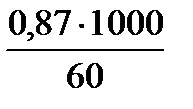 = 14,5 молей/1000г р-ля
= 14,5 молей/1000г р-ля
4. По формуле Dtзам = Kкр.Сm найдем Dt: Dt = 1,86.14,5 = 26,97 0C
5. Dt = tзам н2о – tзамр-ра Þ tзам р-ра = tзам н2о – Dt = 0 - 26,97 = -26,97 0C- температура замерзания 40 % раствора этилового спирта.
Вычислим температуру кипения раствора исходя из I следствия закона Рауля: Dtкип = Kэб. Сm, Сm = 14,5 моль/1000р-ля (см. выше)
Из формулы найдем Dt: Dt = 0,516 . 14,5 = 7,48 0C
Dt = tкипр-ра – tкип н2о Þ tкип р-ра = tкип н2о + Dtкип = 100+7,48=107,48 0C- температура кипения 40% раствора этилового спирта.
Пример 2. Вычислить концентрацию физиологического раствора (NaCl) изотоничного с осмотическим давлением крови равное» 800 Кпа. Степень диссоциации NaCl принять за 90%.
Решение: Для растворов электролитов Росм(NaCl) = i·См·R·T Þ
См = 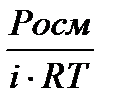 (1)
(1)
Условие изотоничности означает, что Росм(NaCl) = Росм крови = 800 кПа,
i = (n-1)·a + 1= (2 - 1) ·0,9 = 1,9
NaCl Û Na++Cl-, где n = 2, a = 0,9
Подставим найденные значения в формулу (1) См = 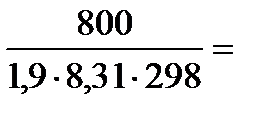 0,17 моль/л – концентрация хлорида натрия, которая создает осмотическое давление 800 кПа.
0,17 моль/л – концентрация хлорида натрия, которая создает осмотическое давление 800 кПа.
Рекомендуемая литература: [1], с.225-230; [2], с.205-208.
Date: 2015-05-09; view: 1470; Нарушение авторских прав