
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Диссоциация солей
|
|
| Средние соли | Кислые и основные соли | Комплексные соли |
| В одну ступень | Диссоциация сложных анионов и катионов – ступенчато (по типу слаб. эл-та) | На комплексный ион и внешнюю сферу как сильный электролит. Комплексный ион – по типу слабого электролита |
| Na2SO4 Û 2Na++SO42- | Na2HPO4Û2Na++HPO42- à HPO42-Û H+-+PO43- ß | К3[Fe(CN)6] Û 3К++[Fe(CN)6]3- à [Fe(CN)6]ÛFe3+ + 6CN- ß |
Способность электролитов проводить электрический ток объясняется распадом нейтральных молекул на заряженные частицы (ионы) под действием полярных молекул растворителя, например воды (теория электролитической диссоциации Аррениуса 1887г.). В зависимости от степени диссоциации (a) все электролиты делятся на сильные и слабые.
Степень диссоциации (распада) a = 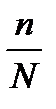 , т.е. отношение числа распавшихся молекул (молей) к общему числу молекул (молей). Часто выражают в процентах: a =
, т.е. отношение числа распавшихся молекул (молей) к общему числу молекул (молей). Часто выражают в процентах: a = 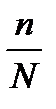 .100%. Например, a = 30 % означает, что из 100 молекул распаду подвергаются 30 молекул.
.100%. Например, a = 30 % означает, что из 100 молекул распаду подвергаются 30 молекул.
Сила электролита характеризуется также константой диссоциации ( Кдис.)
Например, СН3СООН Û СН3СОО- + Н+
слаб.элек-т ß
Кдис = 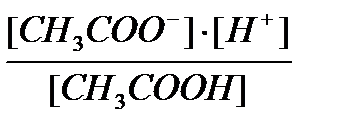 (вследствие закона действующих масс), где [CH3COO-], [CH3COOH], [H+]- концентрации
(вследствие закона действующих масс), где [CH3COO-], [CH3COOH], [H+]- концентрации
Кдис не зависит от концентрации, поэтому является физико-химической константой для данного вещества (приводится в приложении 4 – «Константы диссоциации кислот»). Константа диссоциации слабых электролитов < 10-2. Закон разбавления Оствальда позволяет установить взаимосвязь между константой диссоциации и степенью диссоциации:
Кдис = 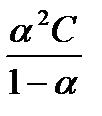 , если a<<1, то Кдис = a2.С, где С- концентрация электролита Þ a =
, если a<<1, то Кдис = a2.С, где С- концентрация электролита Þ a = 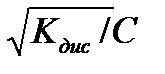
Ионные реакции. При составлении ионной реакции руководствуются принципом Ле-Шателье, т.е. реакция становится необратимой (®) если в результате нее образуются:
а) малорастворимое вещество (осадок) или
б) легколетучее вещество (газ) или
в) малодиссоциирующее вещество (слабый электролит)
Пример 1. Написать уравнения реакции в молекулярной, в полной и краткой ионной формах:
СH3СООН + KOH ® СH3СООK + H2O – молекулярное уравнение
слаб.эл-т сил.эл-т сил.эл-т слаб.эл-т
СH3СООН + K+ +OH-® K ++ СH3СОО -+ 3H2O – ионное уравнение
Данное уравнение отражает состояние вещества в водном растворе с точки зрения теории электролитической диссоциации (сильные электролиты диссоциируют на ионы; слабые – слабо диссоциируют, т.е. существуют в основном в виде нейтральных молекул).
СH3СООН + OH-®- СH3СОО- + 3H2O – краткое ионное уравнение получают, исключив одинаковые ионы в правой и левой части полного ионного уравнения.
Пример 2. Составить молекулярные уравнения исходя из краткого ионного уравнения:
S2- + H+® H2S – краткая ионная форма уравнения
ион ион
K2S + 2HCl ® H2S+2KCl – молекулярная форма уравнения
сил. эл-т сил.эл-т
данное уравнение составлено из утверждения, что иону соответствует сильный электролит.
Рекомендуемая литература: [1], с.231-246; [2], с.218-224.
Date: 2015-05-09; view: 872; Нарушение авторских прав