
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Глава 5. Термодинамика химических процессов
|
|
После изучения этой темы вы должны:
- усвоить понятия: система, процесс, внутренняя энергия, работа, энтальпия, энтропия, энергия Гиббса, эндотермический, экзотермический процесс;
- знать первый закон термодинамики, закон Гесса, расчет изменения энтальпии реакции;
- второй закон термодинамики, уметь на его основе прогнозировать направления самопроизвольного протекания процессов.
Первый закон термодинамики. Теплота, подведенная к системе (тело или группа взаимодействующих тел) идет на совершение системой работы (А) и на изменение внутренней энергии системы (DU): Q = DU + А
А – энергетическая мера направленных форм движущихся частиц. Химическая, электрическая, механическая энергии входят в работу.
DU – прирост внутренней энергии. Внутренняя энергия (U) слагается из вращательного, колебательного движения атомов, молекул, а также энергии движения электронов.
Большинство реакций протекает при Р = const, для этих условий Qр = DU + РDV, где РDV = А.
Qр принято обозначать - DН, т.е. Q р = - DН
DН - называют изменением энтальпии или тепловым эффектом реакции.
Для расчета теплового эффекта используют стандартные теплоты образования (DН0) и сгорания (DН0сгор) веществ.
Тепловой эффект реакции равен сумме теплот образования (DН0) конечных продуктов реакции за вычетом суммы теплот образования начальных веществ (следствие из закона Гесса):
DН = S DН0 (продуктов) - S DН0 (исходных веществ)
Если даны стандартные теплоты сгорания, то тепловой эффект можно вычислить по формуле:
DН =S DН0сгор. (исходных веществ) - S DН0сгор. (продуктов)
DН0, DН0сгор – важнейшие термодинамические характеристики веществ, определенные при стандартных условиях (Т = 298К, р = 1 атм). Теплота образования для простых веществ, устойчивых в стандартных условиях, условно принимаемая равной 0. DН0, зависит от агрегатного состояния.
Тепловой эффект реакции может иметь положительное и отрицательное значения: DН > 0, энергия в ходе реакции поглощается (эндотермический процесс); если DН < 0, энергия в ходе реакции выделяется – экзотермический процесс. Экзотермические реакции протекают с меньшей энергией активации, чем эндотермические (см. главу 5). Высокая энергия активации является причиной того, что многие химические реакции при невысоких температурах не протекают, хотя принципиально возможны. Так, в обычных условиях самопроизвольно не загораются: дерево, бумага, керосин и др. вещества (рис.11).
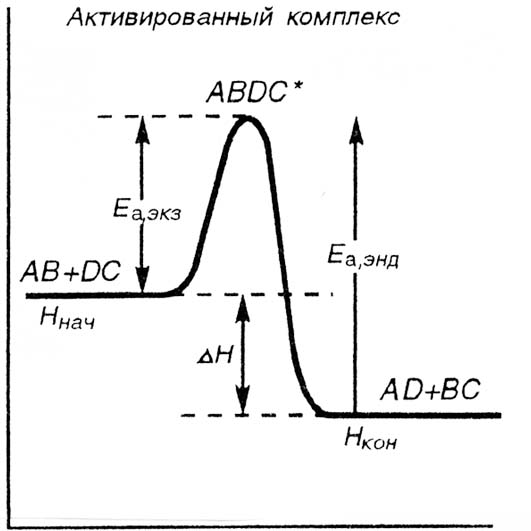
Рис. 11. Энергетическая диаграмма хода реакции с образованием активированного комплекса
Ннач.- Нкон.= DН – теплота реакции (тепловой эффект реакции) которая выделяется в системе при р, Т = const.
Чем определяется способность химической реакции к самопроизвольному протеканию?
Второй закон термодинамики. С точки зрения молекулярно-кинетических представлений второе начало термодинамики можно сформулировать следующим образом: все процессы стремятся перейти самопроизвольно от менее вероятного состояния (например, упорядоченное движение частиц вещества) к состоянию более вероятному – беспорядочное хаотичное движение. Мерой хаотичности выступает термодинамическая функция – энтропия (S). S = J/T [Дж/K].
Различают энтропию вещества (DS0обр) и энтропию процесса (DS). При изменении агрегатных состояний веществ: твердое ® жидкое ® газообразное увеличивается беспорядок, т.е. увеличивается энтропия.
Энтропия реакции равна сумме энтропии (DS0обр) конечных продуктов реакции минус сумма энтропий начальных веществ (следствие из закона Гесса):
DS = S DS0 (продуктов) - S DS0 (исходных веществ)
Наиболее вероятные процессы протекают с ростом энтропии, т.е. DS > 0
Исходя из первого начала термодинамики: DS = Q/T = (DU+A)/T Þ A = TDS - DU, где TDS- часть энергии, которая не может быть превращена в работу, а может только рассеиваться в виде тепла.
Для р, Т = const A = -DG (изобарно-изотермический потенциал) или энергия Гиббса
DG = DН - TDS, DН – количество теплоты выделяемое или поглощаемое в ходе реакции (или изменение теплосодержания) при р, Т= const, DG- часть энергии системы, за счет которой, может быть, совершена работа:
DG > 0 – реакция не возможна;
DG = 0 – система находится в динамическом равновесии;
DG < 0 – реакция протекает самопроизвольно.
Таким образом, химический процесс зависит от энтальпийного ( DН) и энтропийного ( DS) термодинамических факторов системы: чем меньше DН и больше TDS, тем более вероятность протекания реакции.
DG химических реакций, протекающих при стандартных условиях, можно рассчитать по формуле: DG = S DG0 (продуктов) - S DG0 (исходных веществ).
Date: 2015-05-09; view: 970; Нарушение авторских прав