
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энтальпия. Закон Гесса
|
|
В случае исследования процессов, происходящих при постоянном давлении (p = const), целесообразно вместо внутренней энергии U использовать иную функцию состояния, которая будет хорошо описывать термодинамическую систему. Используя выражение для работы во время изменения объема при изобарном процессе (A = pDV), можно записать уравнение для первого закона термодинамики как:
Q = DU + A = DU + pDV = D(U + pV) = DH. (8.32)
Здесь функция H = U + pV называется энтальпией. Как и внутренняя энергия, энтальпия является также функцией состояния термодинамической системы.
В дифференциальной форме последнее выражение имеет вид (при р = const):
dU + pDV = d (U + pV) = dH. (8.33)
Изменение энтальпии DН равно количеству теплоты, которую сообщают системе или отводят от нее при постоянном давлении, вот почему значения DН характеризуют тепловые эффекты фазовых переходов во время испарения, плавления, сгорания, образования соединений из простых веществ.
Изменение энтальпии системы равно разности между энтальпиями конечного и начального состояний: DН = Нк – Нп. Рассмотрим, например, химическую реакцию как термодинамический процесс. Изменение энтальпии в этом случае равно разности энтальпий продуктов реакции и реагентов. Если во время реакции тепло поглощается из окружающей среды, то DH > 0, и наоборот.
Закон Гесса - Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания:
Q = DН = 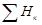 -
- 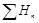 . (8.34)
. (8.34)
Здесь 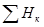 и
и 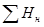 - сумма энтальпий продуктов реакции и исходных веществ, соответственно.
- сумма энтальпий продуктов реакции и исходных веществ, соответственно.
Среди факторов, влияющих на изменение энтальпии, следует отметить температуру, давление, состояние реагентов и продуктов. Для сравнения изменений энтальпии во время разнообразных реакций используют так званые стандартные условия: давление р = 1 атм; температура Т = 298 К; концентрация С = 1 М (1 моль). Определенные при таких условиях значения стандартных энтальпий образования D 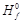 можно найти в таблицах термохимических справочников. В качестве примера приведем значения D
можно найти в таблицах термохимических справочников. В качестве примера приведем значения D 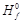 некоторых веществ в табл. 8.4.
некоторых веществ в табл. 8.4.
Табл. 8.4 – Значения стандартных энтальпий образования D 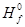 некоторых веществ
некоторых веществ
| Формула | Состояние | Вещество | D 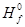 , кДж/моль , кДж/моль
|
| СН4 | Газ | Метан | - 102 |
| О2 | Газ | Кислород | |
| СО2 | Газ | Двуокись углерода | - 393,5 |
| Н2О | Жидкость | Вода | - 285,8 |
| С | Кристалл | Графит | |
| С6H12O6 | Кристалл | a - D -глюкоза | - 1274,4 |
| Н2 | Газ | Водород | |
| С3Н8 | Газ | Пропан | - 104,7 |
Пример
Определить разность энтальпий продуктов реакции окисления 2-х молей глюкозы при постоянном давлении: С6H12O6 + 6O2 ® 6СO2 + 6H2 – Q.
Date: 2015-05-09; view: 908; Нарушение авторских прав