
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Решение. Поскольку удельная теплота испарения воды равна 22,6×105 Дж/кг при атмосферном давлении, теплота
|
|
Поскольку удельная теплота испарения воды равна 22,6×105 Дж/кг при атмосферном давлении, теплота, необходимая для преобразования в пар 1 г води, определится как:
Q = mLисп = (1×10-3 кг)(22,6×105 Дж/кг) = 2260 Дж.
Работа, выполняемая системой, равна:
A = p(Vп – Vв) = (1.013×105 Н×м-2)(1671 – 1) ×10-6 м3 = 169 Дж.
Отсюда изменение внутренней энергии составляет:
DU = Q – A = 2260 Дж – 169 Дж = 2091 Дж.
8.3.6. Применение первого закона термодинамики к определенным
термодинамическим процессам
Уравнение Майера. Уравнение первого закона термодинамики для одного моля газа можно записать в виде:
dU = dQ – pdV = 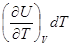 +
+ 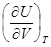 dV. (8.18)
dV. (8.18)
Отсюда:
dQ = 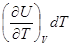 + [ p +
+ [ p + 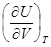 ] dV. (8.19)
] dV. (8.19)
Определим теплоемкость одного моля вещества как молярную теплоемкость. При постоянном объеме молярная теплоемкость определится выражением:
СV = 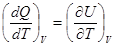 . (8.20)
. (8.20)
При постоянном давлении молярная теплоемкость определится как:
Cp = 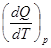 =
= 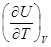 +
+ 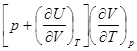 . (8.21)
. (8.21)
Вычитая из уравнения (8.21) уравнение (8.20), получим:
Cp - Cp = 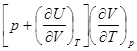 . (8.22)
. (8.22)
Поскольку внутренняя энергия идеального газа зависит лишь от температуры а не от объема, (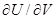 )Т = 0. Для одного моля идеального газа уравнение состояния можно записать в виде:
)Т = 0. Для одного моля идеального газа уравнение состояния можно записать в виде:
p(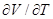 )p = R. (8.23)
)p = R. (8.23)
С учетом этого можно записать уравнение Майера:
Cp – CV = R. (8.24)
Адиабатный процесс. Поскольку адиабатный процесс происходит без теплообмена с окружающей средой, можно, используя уравнение dU = dQ – pdV, получить выражение:
dQ = dU +pdV = 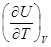 dT +
dT + 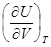 dV +pdV = 0. (8.25)
dV +pdV = 0. (8.25)
Учитывая, что внутренняя энергия идеального газа зависит только от температуры, можно последнее уравнение привести к виду:
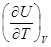 dT + pdV = 0, (8.26)
dT + pdV = 0, (8.26)
Или, используя уравнение (8.20), получить соотношение:
CVdT+ pdV = CVdT + (1/V)RTdV = 0. (8.27)
Поскольку R = Cp – CV, последнее уравнение можно переписать в виде:
dT/T+[(Cp – CV)/CVV]/dV = 0. (8.28)
Интегрирование последнего выражения приводит к уравнению Пуассона:
TVg-1 = const, (8.29)
где g = Сp / СV.
Учитывая уравнение состояния идеального газа, можно получить выражения:
рVg = const; (8.30)
Tg р1-g = const. (8.31)
Date: 2015-05-09; view: 815; Нарушение авторских прав