
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Опыт Эндрюса
|
|
Свойства реальных газов не только в количественном, но и в качественном отношении отличаются от свойств идеальных газов. Теория идеальных газов не может объяснить фазовые превращения газа и жидкости, она не может установить границы области фазовых переходов, параметры критического состояния.
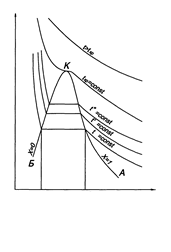
В 1869 г. английский физик Эндрюс впервые на основании проведенных им экспериментов по изотермическому сжатию СО2 построил pv -диаграмму для реального газа и показал на ней характерные граничные линии и области состояний.
|
|
|
|
|
|
|
|
|
|
|
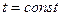 ) сжатия можно по pv -диаграмме, рис. 2. Участок 1-2 кривой сжатия соответствует изменению параметров p и v газообразного состояния вещества. В точке 2 газ сжимается до объема v”, давление газа достигает величины рн – давления насыщения при данной температуре t и газ начинает конденсироваться при
) сжатия можно по pv -диаграмме, рис. 2. Участок 1-2 кривой сжатия соответствует изменению параметров p и v газообразного состояния вещества. В точке 2 газ сжимается до объема v”, давление газа достигает величины рн – давления насыщения при данной температуре t и газ начинает конденсироваться при 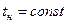 и
и 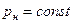 , процесс 2-3. В точке 3 процесс конденсации завершается и весь газ переходит в жидкое состояние и занимает объем v’.
, процесс 2-3. В точке 3 процесс конденсации завершается и весь газ переходит в жидкое состояние и занимает объем v’.
Кривая 3-4 соответствует процессу сжатия жидкой фазы при 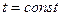 . Поскольку жидкость плохо сжимается, объем здесь меняется мало, а давление резко возрастает.
. Поскольку жидкость плохо сжимается, объем здесь меняется мало, а давление резко возрастает.
Исследуя зависимость v от р на разных изотермах t, t’, t” и т.д., Эндрюс установил, что чем выше температура, тем меньше разница между удельными объемами сухого насыщенного пара 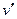 и насыщенной жидкости
и насыщенной жидкости  . С повышением температуры
. С повышением температуры 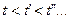 точки 2,
точки 2, 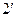 ,
, 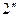 …, образующие верхнюю пограничную кривую АК (линия сухого насыщенного пара, x = 1), сближаются соответственно с точками 3,
…, образующие верхнюю пограничную кривую АК (линия сухого насыщенного пара, x = 1), сближаются соответственно с точками 3, 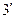 ,
,  …, образующими нижнюю пограничную кривую БК (линия кипящей жидкости, х = 0). Здесь х – степень сухости,
…, образующими нижнюю пограничную кривую БК (линия кипящей жидкости, х = 0). Здесь х – степень сухости,
х = 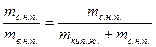 ,
,
где 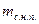 - масса сухого насыщенного пара,
- масса сухого насыщенного пара,
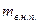 - масса влажного насыщенного пара – смеси кипящей жидкости и сухого насыщенного пара.
- масса влажного насыщенного пара – смеси кипящей жидкости и сухого насыщенного пара.
Разность удельных объемов 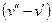 уменьшается до тех пор, пока при некоторой температуре tкр не станет равной нулю, т.е.
уменьшается до тех пор, пока при некоторой температуре tкр не станет равной нулю, т.е.  . Состояние в точке К с параметрами ркр, vкр и tкр назвали критическим. В этой точке исчезают различия между жидкой и газовой фазами. Поэтому, проводя изотермическое сжатие при различных температурах можно графически определить положение критической точки.
. Состояние в точке К с параметрами ркр, vкр и tкр назвали критическим. В этой точке исчезают различия между жидкой и газовой фазами. Поэтому, проводя изотермическое сжатие при различных температурах можно графически определить положение критической точки.
Таким образом, для реального газа в pv -диаграмме можно выделить пять характерных состояний:
· область жидкого состояния – расположена левее кривой х = 0 (БК), 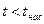 при данном давлении;
при данном давлении;
· линия кипящей (насыщенной) жидкости, х = 0 (БК), 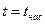 ;
;
· область влажного насыщенного пара – двухфазное состояние, где пар и жидкость находятся в равновесии и имеют одинаковые рн и tн. Она расположена между пограничными кривыми х = 0 и х = 1, т.е. в этой области 0 < x < 1, (между БК и АК), 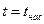 ;
;
· линия сухого насыщенного пара, х = 1 (АК), 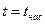 ;
;
· область перегретого пара, расположенную правее кривой х = 1 (АК), 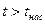 при данном давлении.
при данном давлении.
Необходимо отметить, что при 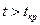 путем простого изотермического сжатия попасть в область фазовых переходов нельзя. Таким образом, газы, у которых
путем простого изотермического сжатия попасть в область фазовых переходов нельзя. Таким образом, газы, у которых 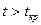 , без понижения температуры нельзя перевести в жидкое состояние.
, без понижения температуры нельзя перевести в жидкое состояние.
В Таблице 1 приведены критические параметры некоторых реальных газов.
Таблица 1
| Параметры | Н2 | N2 | CO2 | O2 | H2O | Hg |
| tкр ., °С | -239,9 | -147,0 | 31,05 | 118,4 | 374,15 | |
| ркр ., МПа | 1,293 | 3,39 | 7,837 | 5,07 | 22,13 | 147,0 |
| vкр ., м3/кг | 0,0323 | 0,00322 | 0,002137 | 0,00233 | 0,00326 | - |
Вещество в критическом состоянии имеет ряд особенностей. Критическая изотерма tкр . в критической точке К имеет горизонтальную касательную и перегиб, т.е.
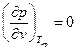 и
и 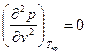 . (6)
. (6)
Вблизи этой точки наблюдается скачек теплоемкости 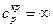 . В точке К теплота парообразования
. В точке К теплота парообразования 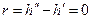 , становятся равными нулю силы поверхностного натяжения
, становятся равными нулю силы поверхностного натяжения 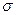 , которые являются наиболее ярким проявлением межмолекулярного взаимодействия. Поэтому в этой точке отсутствует межфазная поверхность, здесь наблюдается высокая растворяющая способность вещества.
, которые являются наиболее ярким проявлением межмолекулярного взаимодействия. Поэтому в этой точке отсутствует межфазная поверхность, здесь наблюдается высокая растворяющая способность вещества.
Особые свойства веществ в критической и околокритической областях состояния в настоящее время уже находят применение в пищевой, фармацевтической, парфюмерной, химической, нефтеперерабатывающей отраслях промышленности, в решении экологических проблем. В частности, показано использование суб- и сверхкритических «флюидов» в роли экстрагентов и растворителей в процессах выделения, разделения, очистки и фракционирования [3]. При этом решаются проблемы создания перспективных малоотходных и энергосберегающих технологий.
Date: 2015-05-09; view: 1125; Нарушение авторских прав