
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основы теории. Идеальным газом называется воображаемый газ, молекулы которого представляют собой материальные точки
|
|
Идеальным газом называется воображаемый газ, молекулы которого представляют собой материальные точки, не имеющие собственного объема и не взаимодействующие между собой. Зависимость между основными термодинамическими параметрами такого газа определяется уравнением состояния идеального газа – уравнением Клапейрона-Менделеева:
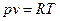 , (1)
, (1)
где 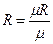
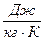 - газовая постоянная;
- газовая постоянная;

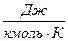 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Реальные газы состоят из молекул, имеющих конечный собственный объем, между которыми действуют силы межмолекулярного взаимодействия (силы притяжения и отталкивания). Эти газы описываются уравнением (1) только при малых плотностях, когда среднее расстояние между центрами молекул сравнительно велико и эти силы не проявляются. В более плотных реальных газах со значительно меньшим расстоянием между молекулами необходимо учитывать и силы взаимодействия, и собственный объем молекул. Поведение реальных газов качественно отражает уравнение Ван-дер-Ваальса:
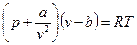 , (2)
, (2)
где 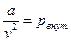 - внутреннее (молекулярное) давление, возникающее за счет действия сил притяжения и отталкивания между молекулами (для жидкостей оно велико);
- внутреннее (молекулярное) давление, возникающее за счет действия сил притяжения и отталкивания между молекулами (для жидкостей оно велико);
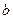 - наименьший объем, до которого можно сжать газ, обусловленный собственным объемом молекул.
- наименьший объем, до которого можно сжать газ, обусловленный собственным объемом молекул.
Тогда 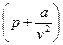 представляет собой полное давление системы, а
представляет собой полное давление системы, а 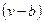 – свободный объем.
– свободный объем.
Для количественных расчетов уравнение (2) часто малопригодно, т.к. при высоких плотностях, а следовательно, при высоких давлениях параметры, рассчитанные по этому уравнению, расходятся с действительными (экспериментальными) значениями.
Уравнение Ван-дер-Ваальса можно представить в приведенных параметрах состояния. Если переменные p, v и T отнести к их значениям в критической точке 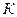 (далее в опыте Эндрюса эта точка будет рассмотрена подробнее), то можно получить приведенные значения объема
(далее в опыте Эндрюса эта точка будет рассмотрена подробнее), то можно получить приведенные значения объема 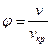 , давления
, давления 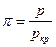 и температуры
и температуры 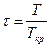 и записать так называемое приведенное уравнение состояния:
и записать так называемое приведенное уравнение состояния:
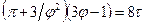 . (3)
. (3)
Состояния веществ, находящихся при одинаковых 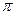 ,
, 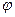 и
и  , называются соответственными состояниями.
, называются соответственными состояниями.
Уравнения типа (2) и (3) получаются в случае, если ограничиться рассмотрением только парных взаимодействий между молекулами, т.е. в группах по две молекулы. Поэтому эти уравнения применимы в области не очень высоких давлений.
С повышением давления необходимо учитывать образование устойчивых молекулярных ассоциаций из трех, четырех и более молекул, распад которых возможен только при подводе энергии извне, т.е. при нагревании. Такой газ можно рассматривать как «смесь» нескольких газов, частицами которых являются одиночные, двойные, тройные и т.д. группы молекул [4, 5].
Уравнение состояния реальных газов формально можно записать в виде:
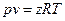 , (4)
, (4)
где z - коэффициент сжимаемости или неидеальности (для идеальных газов z = 1) - можно представить в виде вириального уравнения, учитывающего и взаимодействия более высокого порядка:
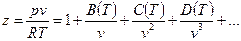 . (5)
. (5)
Правую часть этого уравнения можно рассматривать как разложение в ряд коэффициента z по степеням плотности 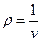 . Зависящие от температуры функции
. Зависящие от температуры функции 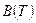 ,
, 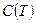 ,
,  … выступают здесь как вириальные (от латинского viris - силы) коэффициенты, учитывающие соответственно парные, тройные, четверные и т.д. взаимодействия. Область справедливости вириального разложения ограничивается сходимостью рядов. Ряды расходятся при плотностях, соответствующих жидкому состоянию. Уравнение (5) оказывается справедливым для газов умеренной плотности. Расчеты вириальных коэффициентов достаточно сложны и поэтому уравнение (5) используется, в основном, при проведении научных исследований.
… выступают здесь как вириальные (от латинского viris - силы) коэффициенты, учитывающие соответственно парные, тройные, четверные и т.д. взаимодействия. Область справедливости вириального разложения ограничивается сходимостью рядов. Ряды расходятся при плотностях, соответствующих жидкому состоянию. Уравнение (5) оказывается справедливым для газов умеренной плотности. Расчеты вириальных коэффициентов достаточно сложны и поэтому уравнение (5) используется, в основном, при проведении научных исследований.
Коэффициент неидеальности z может быть найден также по зависимости 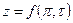 из
из 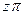 - диаграммы (рис.1).
- диаграммы (рис.1).
|

|
Рассчитанное значение 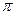 откладывается на соответствующей оси этой диаграммы и из этой точки проводится прямая, перпендикулярная оси
откладывается на соответствующей оси этой диаграммы и из этой точки проводится прямая, перпендикулярная оси 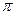 до пересечения с кривой, соответствующей рассчитанному значению t. Точка пересечения позволяет определить искомую величину коэффициента неидеальности на оси z.
до пересечения с кривой, соответствующей рассчитанному значению t. Точка пересечения позволяет определить искомую величину коэффициента неидеальности на оси z.
Точность расчетов в этом случае окажется такой же, как и по уравнению Ван-дер-Ваальса (2) или приведенному уравнению (3).
Date: 2015-05-09; view: 800; Нарушение авторских прав