
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основы теории. Процессы парообразования и конденсации широко распространены в химической технологии
|
|
Процессы парообразования и конденсации широко распространены в химической технологии. Важной теплофизической характеристикой при расчете процессов перегонки, выпарки, ректификации, кипения и сушки является теплота парообразования r.
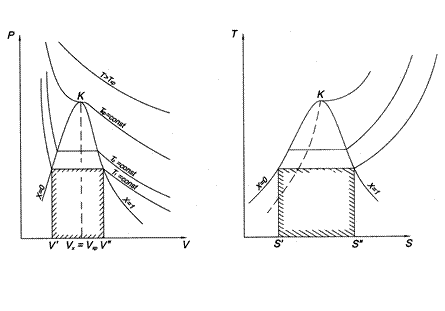
Для исследования термодинамических процессов, происходящих с реальными газами, большое значение имеют pv - и Ts -диаграммы (рис. 1 и 2).
Кривые a1b1c1d1, a2b2c2d2 … на pv -диаграмме соответствуют процессу расширения вещества при t = const, а кривые ab1c1f1, ab2c2f2 … на Ts -диаграмме – процессу нагревания вещества при p = const.
| |||||||||||
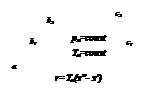 | |||||||||||
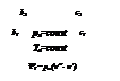 | |||||||||||
 | |||||||||||
| |||||||||||
| |||||||||||
 | |||||||||
| |||||||||
| |||||||||
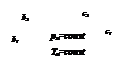 | |||||||||
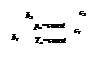 | |||||||||
На обеих диаграммах точки b1, b2,… соответствуют началу процесса парообразования и образуют нижнюю пограничную кривую – кривую кипящей жидкости (х = 0). На этих же диаграммах в точках с1, c2,… процесс парообразования завершается и данные точки образуют верхнюю пограничную кривую, соответствующую сухому насыщенному пару (х = 1). Точки d1, d2,… (рис. 1) и f1, f2,… (рис. 2) соответствуют состоянию перегретого пара, а точкb а – жидкости. Степень сухости:
х = 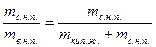 ,
,
где 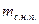 - масса сухого насыщенного пара;
- масса сухого насыщенного пара;
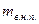 - масса влажного насыщенного пара;
- масса влажного насыщенного пара;
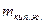 - масса кипящей жидкости.
- масса кипящей жидкости.
|
Таким образом, на обеих диаграммах можно выделить пять характерных состояний водяного пара:
· область жидкого состояния – расположена левее кривой х = 0, 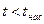 ;
;
· линия кипящей (насыщенной) жидкости, х = 0, 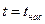 ;
;
· область влажного насыщенного пара – двухфазное состояние, где пар и жидкость находятся в равновесии и имеют одинаковые рн и tн. Она расположена между пограничными кривыми х = 0 и х = 1, т.е. в этой области 0 < x < 1, 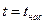 ;
;
· линия сухого насыщенного пара, х = 1, 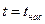 ;
;
· область перегретого пара, расположенную правее кривой х = 1, 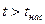 при данном давлении.
при данном давлении.
Переход вещества из одной фазы в другую называется фазовым переходом. Вещества, находящиеся в разных агрегатных состояниях, имеют различные физические свойства. Это различие объясняется характером межмолекулярного взаимодействия.
Количество теплоты, которое необходимо подвести к 1 кг кипящей жидкости для перехода её в сухой насыщенный называется теплотой парообразования r, кДж/кг. Этот процесс протекает при постоянном давлении насыщения и температуре насыщения (рнас= const и tнас = const).
 , (1)
, (1)
где 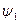 - внешняя составляющая теплоты парообразования – расходуется на работу расширения, преодолевая давление рнас:
- внешняя составляющая теплоты парообразования – расходуется на работу расширения, преодолевая давление рнас:
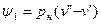 , (2)
, (2)
где 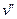 и
и  - удельные объемы сухого насыщенного пара и кипящей жидкости, соответственно;
- удельные объемы сухого насыщенного пара и кипящей жидкости, соответственно;
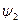 - внутренняя составляющая теплоты парообразования – расходуется на преодоление сил межмолекулярного взаимодействия.
- внутренняя составляющая теплоты парообразования – расходуется на преодоление сил межмолекулярного взаимодействия.
На pv- диаграмме (рис. 1), как следует из уравнения (2), величина работы расширения 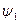 показана заштрихованной областью. На Ts -диаграмме (рис.2) заштрихованной областью показана величина теплоты парообразования, которая может быть рассчитана как:
показана заштрихованной областью. На Ts -диаграмме (рис.2) заштрихованной областью показана величина теплоты парообразования, которая может быть рассчитана как:
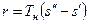 , (3)
, (3)
где 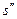 и
и 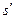 - энтропия сухого насыщенного пара и кипящей жидкости, соответственно,
- энтропия сухого насыщенного пара и кипящей жидкости, соответственно, 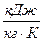 ;
;
Тн - температура насыщения, К.
Из pv- и Тs -диаграмм видно, что с увеличением давления р точки b1, b2,… на нижней пограничной кривой сближаются с точками с1, с2, … на верхней пограничной кривой и в критической точке они сходятся. Для воды критические параметры в точке К имеют следующие значения: ркр. = 22,13 МПа, tкр. = 374,2 °С, vкр. = 0,00326 м3/кг.
Выше критической точки К при p > pкр . и Т > Ткр . двухфазного состояния не наблюдается. Жидкая фаза находится под весьма большим внутренним давлением. Фактором, определяющим интенсивность межмолекулярных взаимодействий, является не давление, а температура. С ростом температуры и давления теплота парообразования r уменьшается, а в критической точке r = 0, 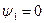 и
и 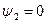 , т.к. в этом состоянии исчезает различие между жидкостью и ее паром и процесс парообразования отсутствует.
, т.к. в этом состоянии исчезает различие между жидкостью и ее паром и процесс парообразования отсутствует.
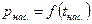 называется кривой насыщения, рис. 3.
называется кривой насыщения, рис. 3.
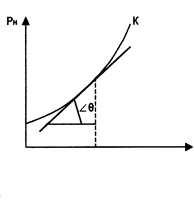 Связь между температурой и давлением насыщения выражается уравнением Клапейрона-Клаузиуса [4, 5].
Связь между температурой и давлением насыщения выражается уравнением Клапейрона-Клаузиуса [4, 5].


|
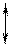
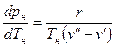 , (4)
, (4)
|


|
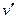 ,
,  - удельные объемы соответственно сухого насыщенного пара и жидкости на линии насыщения при Тнас. и рнас ., м3/кг.
- удельные объемы соответственно сухого насыщенного пара и жидкости на линии насыщения при Тнас. и рнас ., м3/кг.
Поскольку 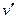 >
>  , из уравнения (4) следует, что при фазовом переходе «жидкость-пар» производная
, из уравнения (4) следует, что при фазовом переходе «жидкость-пар» производная 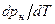 всегда больше нуля, т.е. с ростом давления температура насыщения увеличивается до значения в критической точке.
всегда больше нуля, т.е. с ростом давления температура насыщения увеличивается до значения в критической точке.
В термодинамике внутренняя энергия u,кДж/кг, энтальпия h, кДж/кг, теплоемкость c, кДж/кг К, теплота парообразования r=h”-h’, кДж/кг называются калорическими свойствами вещества (1 калория = 4,19 Дж), удельный объем v, м3/кг, давление p, Па (1 Па = 1 н/м2) и температура T, К – термическими. Известно, что термические параметры определяются намного проще, чем калорические, поскольку устанавливаются прямыми или косвенными измерениями соответствующими приборами. Таким образом, уравнение Клапейрона-Клаузиуса (4) устанавливает связь между термическими и калорическими свойствами, а также свойствами насыщенной жидкости и сухого насыщенного пара. Поэтому уравнение Клапейрона-Клаузиуса можно использовать для определения калорической характеристики – удельной теплоты парообразования воды r по измеренным в опыте термическим параметрам рн и Тн.
Date: 2015-05-09; view: 698; Нарушение авторских прав