
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основы теории. При проведении расчетов процессов и аппаратов химической технологии часто необходимо знать количество подведенной или отведенной теплоты
|
|
При проведении расчетов процессов и аппаратов химической технологии часто необходимо знать количество подведенной или отведенной теплоты. Для их определения используется теплофизическая характеристика – теплоемкость.
Полная теплоемкость – отношение количества теплоты 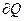 в бесконечно малом термодинамическом процессе к изменению температуры
в бесконечно малом термодинамическом процессе к изменению температуры 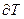 в том же процессе.
в том же процессе.
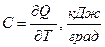 .
.
В практических расчетах используется удельная теплоемкость.
Удельной теплоемкостью называется количество теплоты, которое необходимо подвести к единице количества вещества, чтобы изменить его температуру на 1 градус. В связи с этим определением различают:
- удельную массовую теплоемкость
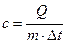 ,
,  ; (a)
; (a)
- удельную объемную теплоемкость
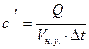 ,
, 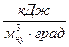 ; (b)
; (b)
- удельную мольную теплоемкость
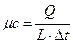 ,
, 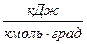 , (c)
, (c)
где m – масса газа, кг;
Vн.у ., 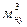 – объем газа, приведенный к нормальным условиям.
– объем газа, приведенный к нормальным условиям.
Приведение объема газа к нормальным условиям связано с тем, что количество вещества (газа) в единице объема зависит от давления р и температуры Т в этом объеме. Чтобы учесть их влияние, объем газа рассчитывают при сопоставимых (например, нормальных) условиях:
(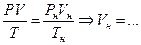 , Рн =760 мм рт. ст.=1,013×105 Па, Тн =273 К);
, Рн =760 мм рт. ст.=1,013×105 Па, Тн =273 К);
L – число киломолей вещества (L=m/µ), кмоль;
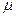 - молекулярная масса газа, кг/кмоль.
- молекулярная масса газа, кг/кмоль.
Тогда расчет теплоты, участвующей в процессе, можно произвести по уравнениям:
 , кДж, (1)
, кДж, (1)
где х – индекс, указывающий характер процесса подвода теплоты Qx, например, при 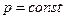 (Qp), при
(Qp), при 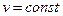 (Qv).
(Qv).
Так как теплота является функцией процесса 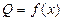 , то и теплоемкость также будут зависеть от характера этого же процесса, то есть
, то и теплоемкость также будут зависеть от характера этого же процесса, то есть 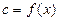 . В связи с этим различают:
. В связи с этим различают:
ср – изобарная теплоемкость;
сv – изохорная теплоемкость.
Эти теплоемкости для идеальных газов связаны уравнением Майера:
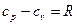 . (2)
. (2)
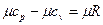 . (2’)
. (2’)
|
|
|
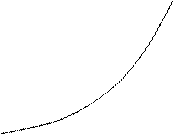

 Теплоемкость зависит от темпе-
Теплоемкость зависит от темпе-
ратуры
|
(рис. 1,а):
сХ=a+bt+et2+….
|
теплоты для нагревания при 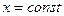
от t1 до t2 в этом случае применяют

 средние теплоемкости
средние теплоемкости 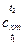 (здесь
(здесь
 индекс «m» означает «средний»!),
индекс «m» означает «средний»!),
|
рассчитываются по средним табличным
значениям теплоемкостей 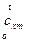 , то есть
, то есть
в интервале температур от 0 до t:
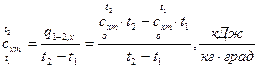 , (3)
, (3)
где 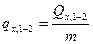 - удельная массовая теплота, кДж/кг.
- удельная массовая теплота, кДж/кг.
Следовательно
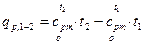 , (4)
, (4)
или 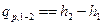 , (4’)
, (4’)
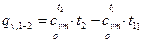 , (5)
, (5)
или 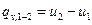 , (5’)
, (5’)
т.е. теплоту можно подсчитать как по значениям теплоемкостей, так и по значениям энтальпий h (при 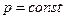 ) и внутренних энергий u (при
) и внутренних энергий u (при 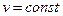 ). Значения
). Значения 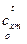 , u и h приводятся в справочной литературе в виде таблиц [1,2].
, u и h приводятся в справочной литературе в виде таблиц [1,2].
При уменьшении интервала температур в выражении (3) получим теплоемкость при заданной температуре t, называемую истинной теплоемкостью, сх,ист.
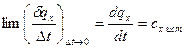 . (6)
. (6)
Со средней теплоемкостью она связана соотношением
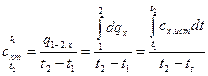 ,
,  . (7)
. (7)
Для приближенных расчетов можно учесть линейную зависимость теплоемкости от температуры (рис. 1, б):
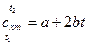 , (8)
, (8)
где a и b – индивидуальные для каждого газа коэффициенты (из таблиц [1]); 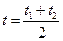 – средняя температура газа.
– средняя температура газа.
Из молекулярно-кинетической теории известно, что энергия, подведенная к системе, состоящей из множества частиц (молекул), распределяется равномерно по степеням свободы i этих частиц. Эта энергия в виде внутренней энергии в идеальном газе распределяется пропорционально степеням свободы поступательного и вращательного движения молекул.
Одноатомная молекула совершает только поступательное движение, то есть изменяется положение молекулы в координатах x, y и z и число степеней свободы i = 3.
Для двухатомной молекулы к трем степеням свободы поступательного движения добавляются две степени свободы вращательного движения вокруг атомов i = 3+2 = 5.
Для трех- и многоатомных газов число степеней свободы принимается равным i =3+3+1= 7 (3 степени свободы в поступательного движения, 3 степени свободы вращательного движения и 1 степень свободы, учитывающая внутримолекулярное движение атомов и силы взаимодействия между молекулами). В соответствии с этой теорией для идеальных газов (для реальных газов – при не очень высоких температурах на каждую степень свободы при 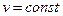 расходуется энергия
расходуется энергия 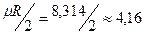 кДж/(кмоль×град). Поэтому постоянные, то есть не зависящие от температуры, мольные теплоемкости
кДж/(кмоль×град). Поэтому постоянные, то есть не зависящие от температуры, мольные теплоемкости 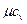 (рис.1, в) можно определить, в зависимости от атомности газа, по числам степеней свободы i, а
(рис.1, в) можно определить, в зависимости от атомности газа, по числам степеней свободы i, а 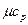 в соответствии с уравнением Майера (2’) - по (i + 2) из Таблицы 1.
в соответствии с уравнением Майера (2’) - по (i + 2) из Таблицы 1.
Таблица 1
| Атомность газов | 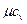 , кДж/(кмоль×град) , кДж/(кмоль×град)
| 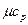 , кДж/(кмоль×град) , кДж/(кмоль×град)
|
| 1 атомные | 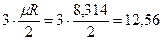
| 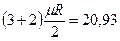
|
| 2 атомные | 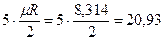
| 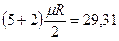
|
| 3 и многоатомные | 
| 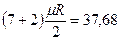
|
Для пересчета различных удельных теплоемкостей удобны соотношения:
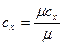 ,
,  ;
; 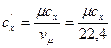 ,
, 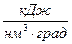 ;
;
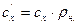 ,
,  , (9)
, (9)
где 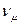 - удельный объем 1 кмоля газа при нормальных условиях,
- удельный объем 1 кмоля газа при нормальных условиях, 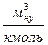 .
.
Date: 2015-05-09; view: 713; Нарушение авторских прав